
根据砷元素的原子结构示意图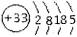 ,做出如下推理,其中与事实不符的是( )
,做出如下推理,其中与事实不符的是( )
A.砷元素位于元素周期的第四周期、第VA族
B.砷原子不如溴原子的得电子能力强
C.砷酸酸性比磷酸酸性强
D.在相同条件砷元素的氢化物的稳定性弱于氨气
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
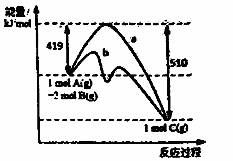
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=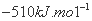
查看答案和解析>>
科目:高中化学 来源: 题型:
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
⑴已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2
CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2
的代数式表示)
(2)制甲醇所需要的氢气,可用下列反应制取:
H2O(g)+CO(g)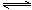 H2(g)+CO2(g)△H < 0 某温度下,该反应的平衡常数K=1。
H2(g)+CO2(g)△H < 0 某温度下,该反应的平衡常数K=1。
①该温度下,若起始时c(CO)= 1 mol/L, c(H2O)= 2 mol/L,反应进行一段时间后,测得H2的浓度为0.5 mol/L,则此时该反应v(正) v(逆) (填>、=、<)。
②若降低温度,该反应的K值将 。(填"增大"、"减小"或"不变" )
③据研究CO(g)+2H2(g) CH3OH(g),制备甲醇的反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: _______________________________________ (用化学方程式表示)。
CH3OH(g),制备甲醇的反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: _______________________________________ (用化学方程式表示)。
(3)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
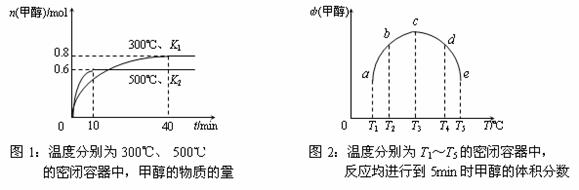
①该反应的ΔH3 0(选填“<”、“>”或“=”,下同),K1 K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有 。
(4)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜的摩尔质量为M g/mol,密度为ρ g/cm3,阿伏加德罗常数为NA,下列说法正确的是( )
A.1 kg铜所含原子的数目为ρ NA B.一个铜原子所占有的体积为M /(ρNA )cm3
C.一个铜原子的质量为 ρ M / NA g D.1 dm3铜所含有的原子数为 ρ NA / M
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构、元素性质的说法正确的是( )
A.ⅠA族元素的金属性一定比ⅡA族的金属性强
B.族序数等于周期序数的元素一定是金属元素
C.全部由非金属元素组成的化合物中只含共价键
D.13C和14C互为同位素,化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应最终有白色沉淀生成的是( )
①金属钠投入到FeCl2溶液中 ②过量NaOH溶液和AlCl3溶液混合
③少量Ca(OH)2投入NaHCO3溶液中 ④过量CO2通入NaAlO2溶液中
A.②③ B.③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.6 g Cu和Mg完全溶于浓硝酸溶液中,反应中硝酸的还原产物为4480mL NO2气和336 mL N2O4气体(标准状况下),反应后的溶液中,加入过量NaOH溶液,生成沉淀的质量为 ( )
A. 9.02 g B. 8.51 g C. 8.26 g D. 7.04 g
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是( )
A. 1:2 B. 1:3 C. 1:4 D. 1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
长期存放的Na2SO3可能部分被氧化。某化学兴趣小组为了测定某无 水Na2SO3被氧化的程度,进行如下实验:
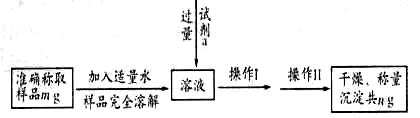 (1) 甲同学设计如下实验流程:
(1) 甲同学设计如下实验流程:
①甲同学选择的试剂a可以是________(填序号)。
A.盐酸酸化后的氯化钡 B.硝酸酸化后的氯化钡 C.氢氧化钡
②判断试剂a是否过量的方法是__________________
③操作II名称是________________________
④Na2SO3的质量分数的表达式为__________________
(2)乙同学准确称量Na2SO3样品mg,并设计如下图所示的实验装置,进行相关实验:
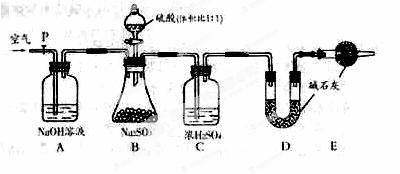
①实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的 空气,这样做的目的是____________________________________。
②装置B中发生反应的化学方程式为:_________________________。
③装置C的作用是_________________________________。
④若实验前后装置D的质量差为ng,则样品中Na2SO3的质量分数的表达式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com