
【题目】如图所示,有关化学反应和能量变化的说法正确的是( )
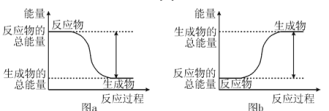
A. 图a表示的是反应中断开化学键吸收的总能量高于形成化学键放出的总能量
B. 图a中生成物比反应物稳定
C. 图b可以表示甲烷燃烧反应的能量变化
D. 图b表示的反应一定需要加热才能发生
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 常温下2S2O(g)![]() 3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D. 氯水通入SO2后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 代表阿伏加德罗常数,下列说法正确的是
A.含1mol的C2H5OH水溶液,氢原子总数为6NA
B.标准状况下,体积为22.4L的CO2、NO混合气体,氧原子数一定小于NA
C.标准状况下,11.2L SO3所含的分子数为0.5NA
D.将1L 2mol·L-1的FeCl3溶液制成胶体后,其中含有的氢氧化铁胶粒数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取500mL Na2CO3溶液与300mL 1mol/L盐酸反应。在不断搅拌下,将Na2CO3溶液逐滴滴入盐酸中与将盐酸逐滴滴入Na2CO3溶液中,所产生气体的物质的量之比为3:2,则Na2CO3溶液的物质的量浓度为
A.0.4mol/LB.0.3mol/LC.0.2mol/LD.0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将![]() 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
D.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是
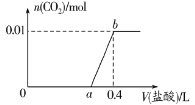
A.在0~a范围内,只发生中和反应
B.a=0.2
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到20mL1mol/L的盐酸中,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积(mL)变化的关系如图所示。下列说法不正确的是( )
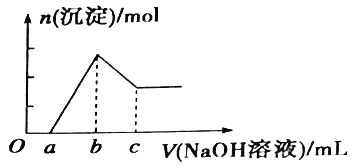
A. 镁、铝形成合金后硬度增强,熔点降低B. ab段可以计算出合金中Mg的含量
C. c值越大,合金中Al的含量越高D. 加入NaOH溶液后,只发生了4个离子反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com