
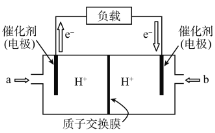
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
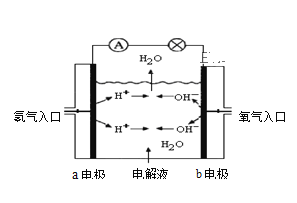
(1)下列叙述不正确的是 ______ 。
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极 _________,b极 ____________;
(3)若电解质溶液为稀H2SO4,则电极反应式为:a极 __________,b极____________。
【答案】B 2H2-4e-+4OH-=4H2O O2+2H2O+4e-=4OH- 2H2-4e-=4H+ O2+4H++4e-=2H2O
【解析】
(1)在氢氧燃料电池中,氢气失电子发生氧化反应,通入氢气的电极是负极,氧气得电子发生还原反应,通入氧气的电极是正极;
(2)当电解质溶液是KOH时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子;
(3)当电解质溶液是H2SO4时,负极上氢气生成氢离子,正极上氧气和氢离子反应生成水。
(1)A.在氢氧燃料电池中,H2失电子发生氧化反应,因此通入氢气的a极为电源的负极,A正确;
B.在氢氧燃料电池中,通入O2的b极为原电池的正极,正极上O2得电子发生还原反应,要结合电解质溶液的酸碱性来确定其电极反应式的书写,B错误;
C.氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,C正确;
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,D正确;
故合理选项是B;
(2)当电解质是碱溶液时,燃料氢气失电子生成的H+在碱性溶液中不能稳定存在,它和OH-反应生成H2O,所以负极上发生的电极反应式为2H2-4e-+4OH-=4H2O;正极上O2得电子和水生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-;
(3)负极上失电子发生氧化反应,若电解质溶液是酸,则负极上氢气失电子后生成H+,其电极反应式为:2H2-4e-=4H+;正极上氧气得电子和氢离子反应生成水,发生还原反应,故其电极反应式为:O2+4H++4e-=2H2O。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是( )
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是( )
A.平衡向正反应方向移动 B.x+y<z
C.B的物质的量浓度减小 D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
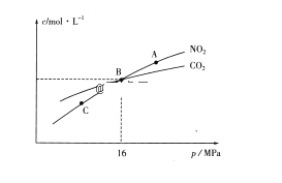
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是

A.X为氧气
B.电极A反应式:CH3CH2OH-12e-+3H2O=2CO2+12H+
C.电极材料活泼性:A>B
D.B电极附近溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯法合成氨技术的相关反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-93kJ/mol
2NH3(g) △H=-93kJ/mol
(1)试根据表中所列键能数据计算a的数值为_____________。

(2)在600℃下,向2L密闭容器中充入一定量的反应物并开始上述反应,图表示N2的物质的量随时间的变化曲线。
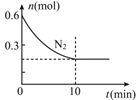
用H2表示0~10min内该反应的平均速率v(H2)= _____________,若该温度下K=0.0016L2/mol2,则在10min时c(H2)= _____________。
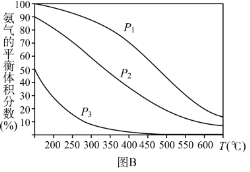
(3)在哈伯合成法中,平衡时NH3的体积分数与反应体系的压强(P)、温度(T)的关系如图B。则P1_____________P2(选填¨大于”、“小于”或¨不能确定”),其他条件相同,不同压强下在刚开始反应时反应物活化分子浓度较大的是_____________(选填“P1”、“P2”、“P3”或“不能确定”),在日本的合成氨工业中,选择合成温度为700℃的较高温,试从化学动力学的角度分析其理由是_____________。
(4)研究表明,合成氨的速率与相关物质的浓度的关系为v=kc(N2)c(H2)3/2c(NH3)-1,k为速率常数。能使合成氨的速率增大的措施是_____________。
A.使用更有效的催化剂
B.总压强一定,增大n(N2 )/n(H2)的值
C.升高反应温度
D.按照原来比值增大反应物的浓度
E.将原容器中NH3及时分离出来
(5)如图是利用NH3催化氧化释放出电能的电池结构示意图(氧化产物为无污染性气体),放电时O2应从_____________(填“a”或“b”)处通入,该电池负极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国的“四大发明”之一.黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S═K2S+N2↑+3CO2↑.该反应中,被氧化的元素是______,氧化剂是______,氧化产物是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系
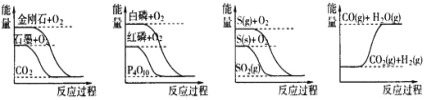
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B. 白磷比红磷稳定
C. ①S(g)+O2(g)=SO2(g);②S(s)+O2(g)=SO2(g);放出热量:①②
D. CO(g)+H2O(g)=CO2(g)+ H2 (g);该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的甲、乙两种气体的质量比是17:14。若乙气体是氮气,则甲气体是( )
A. H2S B. Cl2 C. NH3 D. HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com