
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,分析 由方程式可知,Cu被氧化,为原电池的负极,则正极可为碳棒或不如Cu活泼的金属,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,据此分析解答.
解答 解:由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,正极可为碳棒,电解质溶液为氯化铁,
则原电池装置图可设计为 ,
,
故答案为:(1) ;(2)Cu;Cu-2e-=Cu2+;碳棒;2Fe3++2e-=2Fe2+;氯化铁溶液.
;(2)Cu;Cu-2e-=Cu2+;碳棒;2Fe3++2e-=2Fe2+;氯化铁溶液.
点评 本题考查了原电池的知识,属于基础性知识的考查,题目难度不大,明确原电池的工作原理、构成条件是答题的关键,注意相关知识的积累和总结.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在氧气中的燃烧 | |
| D. | 白磷自燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容量 | 甲 | 乙 | 丙 | 丁 |
| A | 2mol | 1mol | 2mol | 1mol |
| B | 1mol | 1mol | 2mol | 2mol |
| A. | A的转化率:丁>丙>乙>甲 | B. | A的转化率:丁>乙>丙>甲 | ||
| C. | B的转化率:丙>甲>乙>丁 | D. | B的转化率:甲>乙>丙>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
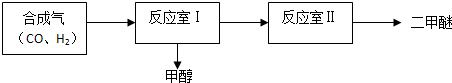
| 序号 | 温度(°C) | 起始浓度(mol•L-1) | 平衡浓度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
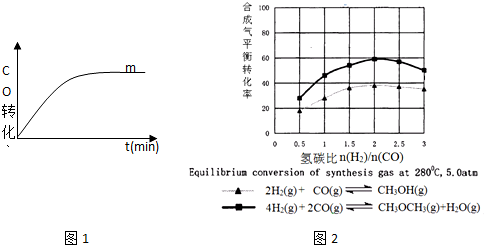
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
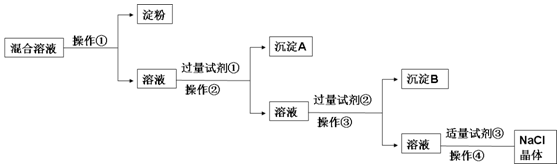
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
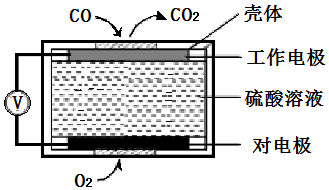
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.2 g CO | B. | 6.6 g CO2 | C. | 8 g SO2 | D. | 9.8 g H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com