
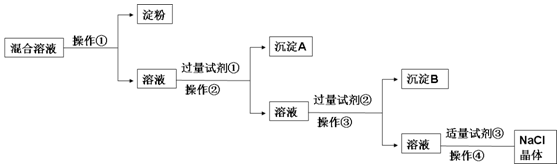
分析 胶体不能透过半透膜,操作①为渗析,除去Na2SO4、CaCl2,可分别加入BaCl2、Na2CO3,除去粗盐中含有的Ca2+、SO42-可溶性杂质的方法:加入过量BaCl2,去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体,以此解答该题.
解答 解:(1)淀粉为胶体,粒子直径较大,不能透过半透膜,所以可以把淀粉胶体和溶液进行分离,故答案为:半透膜;
(2)由以上分析可知试剂①为BaCl2,试剂③为HCl,故答案为:BaCl2;HCl;
(3)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量,
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;
(4)试剂③为盐酸,加入盐酸可除去过量的Na2CO3,同时产生气泡,所以控制试剂③适量的方法是观察溶液中是否有气泡出现,当溶液中不产生气泡时,就可以停止加盐酸,故答案为:当溶液中不产生气泡时,就可以停止加盐酸;
(5)试剂②为Na2CO3,是用来除去溶液中的钡离子的,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查物质的分离提纯操作以及溶液的配制,为高频考点,题目难度中等,本题注意Ca2+、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com