
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 要除去乙烷中混有的乙烯气体可将混合气体通过盛有酸性高猛酸钾溶液的洗气瓶 | |
| D. | 用分液漏斗可以分离溴和CCl4、苯和水、乙酸和乙醇等液体混合物 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L乙烯中C-H键数为4NA | |
| B. | 1L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 上述现象说明[Cu(NH3)4]2+不如Cu(OH)2稳定 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH2CH2CH2CH3 | B. | CH3CH2CH═CHCH2CH3 | ||
| C. | CH3CH═CHCH2CH2CH3 | D. | 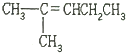 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 3:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com