
| A. | 常温常压下,22.4L乙烯中C-H键数为4NA | |
| B. | 1L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
分析 A.常温常压下,气体摩尔体积大于22.4L/mol;
B.乙酸是弱酸,不能完全电离;
C.乙烯和丁烯的最简式为CH2,只需计算21.0gCH2中碳原子数;
D.标准状况甲醇不是气体.
解答 解:A.常温常压下,气体摩尔体积大于22.4L/mol,故A错误;
B.乙酸是弱酸,不能完全电离;1L0.1mol•L-1乙酸溶液中H+数小于0.1NA,故B正确;
C.乙烯和丁烯的最简式为CH2,只需计算21.0gCH2中碳原子数═$\frac{21g}{14g/mol}$×NA=1.5NA,标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA ,故C正确;
D.标准状况甲醇不是气体,22.4L甲醇物质的量不是1mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用概念理解,微粒数计算,气体摩尔体积的条件应用,物质性质的分析判断是解题关键.题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①②③④⑤ | C. | ②⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 5.6g | C. | 11.2g | D. | 1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐:Ca(ClO)2 NH4NO3 K2SiO3 | |
| B. | 酸性氧化物:Al2O3 K2O CO2 | |
| C. | 电解质:HCl Ba(OH)2 CO | |
| D. | 非电解质:Cl2 NO 乙醇(C2H5OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3PO4 | B. | Na3PO3 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X.Y形成的最简单化合物的稳定性:X>Y | |
| B. | Z位于元素周期表的第三周期第IA族 | |
| C. | Q与R两元素组成的分子构型是正四面体型 | |
| D. | X、Y最多可以形成5种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 要除去乙烷中混有的乙烯气体可将混合气体通过盛有酸性高猛酸钾溶液的洗气瓶 | |
| D. | 用分液漏斗可以分离溴和CCl4、苯和水、乙酸和乙醇等液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
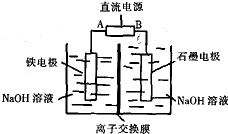 高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:
高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com