
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________。
(3)若将ZnS溶于强酸可产生硫化氢气体。在120 oC、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数。(不考虑硫化氢气体自身受热分解)
(4)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
(1)0.93 (3分)
(2)S (3分)
(3)60%或70% (4分)
(4)

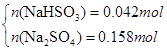
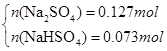 (4分)
(4分)
解析试题分析:(1)解析:设闪锌矿中ZnS的质量为x,杂质为y
2ZnS+3O2="2" ZnO+2SO2
x/97 x/97
有
解得x=1.455g,y=0.105g,所以样品中w(ZnS)=1.455g÷1.56g×100%=93%
(2)解析:设浓硫酸被还原的产物中S的化合价为x。
根据题意过量的硫酸用碱滴定,则过量的硫酸n(H2SO4)= n(NaOH)×1000/15="0.25" mol/L×0.02170 L×1000/15=0.1808mol,所以反应的硫酸n(H2SO4)="18.4" mol/L×0.012L-0.1808mol=0.04mol,又反应后溶液为硫酸锌,所以n(ZnSO4)= n(Zn)="1.95" g÷65g/mol=0.03mol,所以作酸的硫酸n(H2SO4)= n(ZnSO4)=0.03mol,做氧化剂硫酸n(H2SO4)=0.04mol-0.03mol=0.01mol,因为Zn反应0.03mol失去0.06mol电子,所以根据得失电子守恒,(+6-x) ×0.01mol=0.06mol,解得x=0,所以还原产物中S的化合价为0价,还原产物为S单质。
(3)解析:在120 oC、1 atm下,设硫化氢和氧气体积分别为x、y,点燃生成的都是气态产物,由于比例不定,
所以若氧气过量,则有:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)
2 3 2 2
x y x x
解得x=60ml,y=40ml;所以此时硫化氢的百分数为60ml÷100ml×100%=60%
若硫化氢过量,则有:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)
2 3 2 2
x y 2/3y 2/3y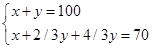
解得x=10ml,y=90ml;此时得到数据不满足条件舍去。
(4)解析:n(SO2)=0.2mol,通入未知浓度的NaOH溶液,若NaOH溶液过量则所得溶液为Na2SO3 、NaOH;若恰好完全反应则所的溶液为Na2SO3 溶液;若SO2稍过量则所得溶液为Na2SO3 、NaHSO3 ;若SO2过量恰好完全被吸收则生成NaHSO3 溶液;
(1)若所得溶液为Na2SO3 、NaOH:则有n(Na2SO3)= n(SO2)=0.2mol,则m(Na2SO3)=25.2g<26.8g,
蒸干后若得到的是Na2SO3 、NaOH时,满足条件,此时m(NaOH)= 26.8g-25.2g=1.6g,即n(NaOH)=0.04mol.
(2)若恰好完全反应所得溶液为Na2SO3 :因n(Na2SO3)= n(SO2)=0.2mol,则m(Na2SO3)=25.2g<26.8g,蒸干后必有部分Na2SO3 被氧化为Na2SO4 ;设n(Na2SO3)=x,n(Na2SO4)=y,则有: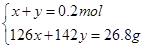
解得x=0.1mol,y=0.1mol即n(Na2SO3)=0.1mol,n(Na2SO4)= 0.1mol.
(3)若SO2稍过量所得溶液为Na2SO3 、NaHSO3 :当蒸干后固体全为Na2SO3时,m(Na2SO3)=25.2g<26.8g,所以蒸干溶液后所得晶体不可能是Na2SO3 、NaHSO3 组合;当蒸干后固体全为Na2SO4 时,m(Na2SO4)="0.2mol×142g/mol=28.4g" >26.8g,所以蒸干后不可能全是Na2SO4,可以是Na2SO4 和NaHSO3或者是Na2SO4 和NaHSO4 ,因此有
设n(NaHSO3)=x,n(Na2SO4)=y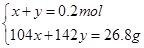
解得x=0.042mol,y=0.158mol即n(NaHSO3)= 0.042mol,n(Na2SO4)= 0.158mol
设n(NaHSO4)=x,n(Na2SO4)=y
解得x=0.073mol,y=0.127mol即n(NaHSO3)= 0.073mol,n(Na2SO4)= 0.127mol
(4)若SO2过量恰好被吸收所得溶液为NaHSO3 :则蒸干后所得固体无论是NaHSO3 还是NaHSO4 或者二者混合,都不可能。
考点:本题考查的是氧化还原计算、金属与酸反应计算、多元酸的酸性氧化物与碱反应的计算。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
(1)同温同压下,同体积的NH3和H2S气体的质量比是___________;同质量的NH3和H2S气体的体积比是__________;同质量的NH3和H2S气体中所含氢原子个数比是___________;若两者所含氢原子个数相等,它们的物质的量比是________。
(2)Na2SO4??10H2O的摩尔质量是__________,483gNa2SO4??10H2O中所含Na2SO4??10H2O的物质的量是_______,所含Na+的物质的量是_________,所含H2O分子的数目是_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将3.25g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:(1)反应中生成的H2在标准状况下的体积;
(2)所用盐酸中HCl的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将6.4 g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:(要求有计算过程)
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在标准状况下,将44.8LHCl溶于927mL水(密度为1g/cm3)中,所得盐酸的密度为1.05g/cm3,计算所得盐酸的溶质质量分数及物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把2.0 mol/L CuSO4溶液和1.0 mol/LH2SO4溶液各100 mL混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:
(1)混合液中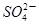 的物质的量浓度_____________mol/L;
的物质的量浓度_____________mol/L;
(2)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余。此时,生成气体的体积(标准状况)为_________________L,溶液中Fe2+的物质的量浓度是___________mol/L;
(3)向混合溶液中滴加1 mol/L的NaOH溶液,使Cu2+恰好完全沉淀,所需NaOH溶液的体积_____________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
测定1 mol氧气在标准状况下所占体积的实验操作步骤如下:
①按下图装配实验装置。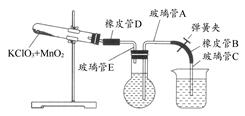
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置放置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口,一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com