
| A、高铁酸钾中铁显+3价 | B、湿法中每生成1mol Na2FeO4 转移3mol电子 | C、干法中每生成1mol Na2FeO4 转移4mol电子 | D、K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
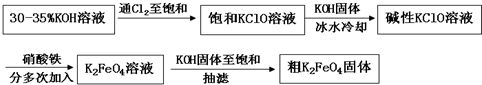
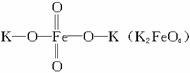 是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要方程式为:2Fe(OH)3+2ClO-+4OH-====2
是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要方程式为:2Fe(OH)3+2ClO-+4OH-====2A.高铁酸钠中铁显+6价
B.湿法中每生成1 mol Na2FeO4反应中转移3 mol电子
C.干法中每生成1 mol Na2FeO4反应中转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
查看答案和解析>>
科目:高中化学 来源:2013届山东省新泰市汶城中学高三12月月考化学试卷(带解析) 题型:填空题
(6分)铁及其化合物之间的相互转化可用下式表示: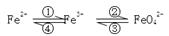
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是 (选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e- 时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安微省池州市高三上学期第三次月考化学试卷(解析版) 题型:填空题
高铁酸钾是一种新型高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:
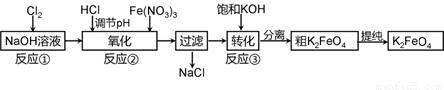
(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量。实验室用pH试纸测定溶液pH的操作是 。
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
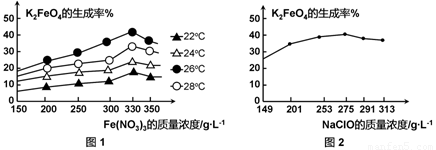
工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
(4)K2FeO4 在水溶液中易“水解”:4FeO42- + 10H2O  4Fe(OH)3
+ 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3
+ 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(5)K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。根据污染物的实际情况向水中加入适量的K2FeO4将污染物转化为无污染的物质,试写出K2FeO4处理含有NH3污水时与NH3反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com