
����Ŀ����2017�콭��ʦ���и���12���¿���ѧ�Ծ�������ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽�����
��1����ͼ1Ϊijʵ��С����Ƶ�ԭ���װ�ã���Ӧǰ���缫������ȣ�һ��ʱ������缫�������12 g��������ͨ��________mol���ӡ�

��2����ͼ�������������䣬�������ձ��е�CuCl2��Һ��ΪNH4Cl��Һ����ʯī�缫�ĵ缫��Ӧ����ʽΪ_____________________

��3����ͼ�������������䣬�������Ż�����ͭ������ʯī������n�ͣ�����ͼ��ʾ��װ������ͭ˿������ʯī�缫�Ϸ����ķ�Ӧ����ʽΪ_____________________
���������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
��1�������͵�ȼ����ȣ�������Ϊȼ�ϵ��������Ե��ŵ���________________��д���㣩
��2�����������ĸ���ƷҲ����������Դ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ����������ܷ�Ӧ����ʽΪ��Fe+2H2O+2OH![]() FeO42+3H2��������ԭ������ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
FeO42+3H2��������ԭ������ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��

�����һ��ʱ���c(OH)���͵�������________________(������������������������)
���������У��뽫�������������弰ʱ�ų�����ԭ����______________________
��c( Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2����ѡM��N�����е�һ�㣬����c(Na2FeO4)�������ֵ��ԭ��_____________��
���𰸡�������1��0.2mol ��2��2NH4++2e-��2NH3��+H2�� ��3��2Cl--2e-��Cl2��
������1��ȼ����ֵ�� ȼ������Ⱦ �ǿ�������Դ ��д���㣩��2����������
����ֹ���ɵ�H2��������Ʒ�Ӧ��ʹ�������ƵIJ��ʽ���
��M�㣺������Ũ��ƫС���������Ƶ��ȶ��Բ�ҷ�Ӧ������
N�㣺������Ũ�Ƚϴ����缫��������������������ʹ�������ƵIJ��ʽ���
��������
���������������1��ͼ1Ϊԭ��ط�Ӧ��FeΪ������������Fe-2e��=Fe2����ʯīΪ����������Cu2++2e-=Cu���ܷ�ӦʽΪFe+Cu2+=Fe2++Cu��һ��ʱ������缫�������12g����
Fe+Cu2+=Fe2++Cu ������������m ת�Ƶ���
56g 64g 56g+64g=120g 2mol
12g n
��n=0.2mol��
��2������CuCl2��Һ��ΪNH4Cl��Һ����Һ�����ԣ�笠��������ŵ磬�缫��ӦʽΪ2NH4++2e-��2NH3��+H2����
��3���������Ż�����ͭ������ʯī������n�ͣ���װ��Ϊ����������ʴ����Ϊ������ͭΪ�������������� O2+2H2O+4e-��4OH-���ʼ��ԣ��μӷ�̪����Һ��죬����װ��ͭΪ������ʯīΪ��������Ϊ����װ�ã���������2Cl--2e-��Cl2����
������1����������ȣ�������Ϊȼ�ϵ��ŵ�����ȾС������������Դ�㡢��Դ�ḻ��ȼ����ֵ�ߵȣ���2���������������缫�����ݲ����������ӷŵ��������������缫����������Ӧ����Һ�е����������Ӽ��٣���˵��һ��ʱ���c��OH-�����͵������������ң�
���������л�ԭ�ԣ���������Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ���������У��뽫�������������弰ʱ�ų�����ֹNa2FeO4��H2��Ӧʹ���ʽ��ͣ�
����������Na2FeO4ֻ��ǿ�����������ȶ�����M�㣬c��OH���ͣ�Na2FeO4�ȶ��Բ�ҷ�Ӧ������N�㣺c��OH-�����ߣ����缫���������������ɣ�ʹNa2FeO4���ʽ��͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ������ˮ�еμ�Ũ����Ĺ����У�Kw���ֲ���
B. �������Һǡ����ȫ��Ӧʱ������Һһ��������
C. ���������Һ�м������������ᣬˮ�ĵ���ȼ�С
D. �㷺pH��ֽ�ܹ������Һ�ľ�ȷpH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�صĻ��ϼ�̬���жϣ����������е���Ԫ�ز��ܱ��������Ե��ǣ�������
A.Na2S
B.S
C.SO2
D.H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH4Br�����ܱ������У���ijһ�¶��£��������з�Ӧ��NH4Br![]() NH3(g) + HBr(g) �� 2HBr
NH3(g) + HBr(g) �� 2HBr![]() H2(g) + Br2(g) �������Ӻ��֪H2Ϊ0.5mol/L ��HBrΪ4mol/L ����NH4Br �ķֽ�������v(NH3)��ʾ������������ȷ����( )
H2(g) + Br2(g) �������Ӻ��֪H2Ϊ0.5mol/L ��HBrΪ4mol/L ����NH4Br �ķֽ�������v(NH3)��ʾ������������ȷ����( )
A. 0.5mol��L-1��min-1 B. 2.5 mol��L-1��min-1
C. 2mol��L-1��min-1 D. 1.2 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������˵����ȷ����( )
A. ������������Ҳ������B. ���е����������״�
C. �������ؼ���������ת����Ӱ�����ǿ��D. �����������ص��̶ȴ��γɵĹ��ۼ�ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��ܹ�����ĵ�����ǣ�������
A.ͭ˿
B.���ڵ�MgCl2
C.NaCl��Һ
D.�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �����Ҫ�ϳ�
�����Ҫ�ϳ� ![]() �����õ�ԭʼԭ�Ͽ����ǣ� ��
�����õ�ԭʼԭ�Ͽ����ǣ� ��
A. 2 -��-l��3 -����ϩ��1 -��Ȳ B. l��3 �C���ϩ��2 -��Ȳ
C. 2��3 -����-1��3 -���ϩ����Ȳ D. 2��3 -����-l��3 -����ϩ�ͱ�Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij��ϩ��A̼ԭ����С��8����HBr�ӳɲ���ֻ��һ�ֽṹ����A��H2�ӳɺ�����������һ±�����ͬ���칹����3�֣���A�Ľṹ��ʽΪ_________________��
��2����ϩ������ϳɲ��ϵĻ���ԭ�ϣ������ںϳ�Ӧ�ù㷺��DAP��֬�����˫�ӵ��л��������Ҫ�Ĺ�ҵ��;��
��д����ϩ��һ�������·����ۺϷ�Ӧ�Ļ�ѧ����ʽ______________��
�ڱ�ϩ��������������O2��Ӧ�����л���A���������ܶ�����ͬ״���¼����ܶȵ�6.25����Ԫ�ص���������Ϊ��̼60%����32%��A�ķ���ʽΪ__________��
��3��ijϩ����H2�����ӳɷ�Ӧ��õ��IJ�����CH3��CH��CH3��2��
�ٸò����������____________________��
��д��ԭ����ϩ��ʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ��Ӧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������dz��ͭɫ�������Ľ�������������Ϊ�ǻƽ𣬹��ֳ�Ϊ�����˽𡱡�ij��ѧ��ȤС���ij������ʯ(��Ҫ�ɷ�ΪFeS2)��������ʵ��̽����
[ʵ��һ]���ⶨ��Ԫ�صĺ���
I����m1g�û�������Ʒ��������ͼ��ʾװ��(�гֺͼ���װ��ʡ��)��ʯӢ���У���a�����ϵػ���ͨ���������������ʯӢ���еĻ�������Ʒ����Ӧ��ȫ�õ�����ɫ�����һ�ִ̼�����ζ�����塣
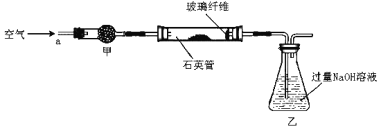
��Ӧ��������ƿ�е���Һ�������´�����
�������ۣ�
��1��д��ʯӢ���з�����Ӧ�Ļ�ѧ����ʽΪ��_________________________________��
��2��I�У�����ܼ�����ʢ�Լ���__________����ͬѧ�����ʵ��װ�ô��ڰ�ȫ���������ü�������˵����_________________________________________��
��3���û�����ʯ����Ԫ�ص���������Ϊ_____________________��
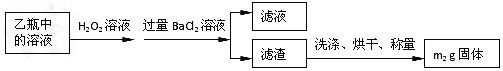
[ʵ���]���������ʵ�鷽���ⶨ��Ԫ�صĺ���
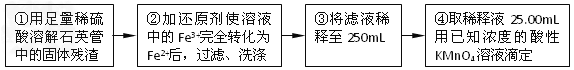
�������ۣ�
��4�����У���ѡ����������ԭ������ʹ�������______�����Ӱ�족����ƫ�ߡ���ƫ�͡�����
��5�����У���Ҫ�õ��IJ����������ձ�������������ͷ�ι��⣬����____________��
��6�����з�����Ӧ�����ӷ���ʽΪ__________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com