
分析 (1)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)稀释前后溶质硫酸的物质的量不变,根据稀释定律计算需要浓硫酸的体积.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,质量分数为98%、密度为1.8g•mL-1的浓H2SO4的物质的量浓度=$\frac{1000×1.8×98%}{98}$mol/L=18mol/L,
答:质量分数为98%、密度为1.8g•mL-1的浓H2SO4的物质的量浓度为18mol/L;
(2)稀释前后溶质硫酸的物质的量不变,根据稀释定律,需要浓硫酸的体积为$\frac{250mL×0.4mol/L}{18mol/L}$=5.6mL,
答:需要浓硫酸的体积为5.6mL.
点评 本题考查物质的量浓度有关计算,注意理解掌握物质的量浓度与质量分数之间关系.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
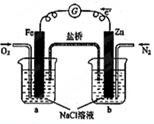
| A. | 向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成 | |
| B. | 烧杯b中发生反应为Zn+2e-=Zn2+ | |
| C. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| D. | 烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中水电离出的c(H+)=10-10 mol•L-1 | |
| B. | 溶液中c(H+)+c(A-)=0.1 mol•L-1 | |
| C. | 与0.05 mol•L-1 NaOH溶液等体积混合,水的电离平衡向正向移动 | |
| D. | 上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HA)<c(A-) | B. | c(Na+)=c(A-)+c(HA) | ||
| C. | c(HA)-c(A-)=c(OH-) | D. | c(HA)+c(A-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 不可用氢氧化钙鉴别两者 | |
| C. | 两溶液碱性相同时的浓度:Na2CO3>NaHCO3 | |
| D. | 与同浓度的硫酸溶液反应放出气泡的快慢程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中铁单质物质的量的范围:0.03 mol<n(Fe)<0.07 mol | |
| B. | 往得到的溶液中加入NaOH溶液现象为白色沉淀转化为灰绿色最后变为红褐色 | |
| C. | n(Fe)<n(Fe2O3) | |
| D. | 反应后所得溶液中的Fe2+与Cl-的物质的量之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com