
| A. | 混合物中铁单质物质的量的范围:0.03 mol<n(Fe)<0.07 mol | |
| B. | 往得到的溶液中加入NaOH溶液现象为白色沉淀转化为灰绿色最后变为红褐色 | |
| C. | n(Fe)<n(Fe2O3) | |
| D. | 反应后所得溶液中的Fe2+与Cl-的物质的量之比为1:2 |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无不显红色,说明反应后的溶液为FeCl2溶液,Fe发生反应:Fe+2HCl=FeCl2+H2↑,Fe+Fe2O3+6HCl=3FeCl2+3H2O,标况下生成672mL氢气,其物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,则反应生成氢气时消耗的Fe为0.03mol、消耗的HCl为0.03mol×2=0.06mol.由Fe原子、Cl原子守恒可知,n(Fe元素)=n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.3L×1mol/L=0.15mol.
A.混合物只有Fe、Fe2O3时,Fe的物质的量达极大值,只有Fe、FeO时,Fe的物质的量达极小值;
B.最后得到的为FeCl2溶液,加入NaOH溶液开始生成氢氧化亚铁,然后氢氧化亚铁被氧化为氢氧化铁;
C.由方程式Fe+2HCl=FeCl2+H2↑、Fe+Fe2O3+6HCl=3FeCl2+3H2O判断;
D.最后得到的为FeCl2溶液.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无不显红色,说明反应后的溶液为FeCl2溶液,Fe发生反应:Fe+2HCl=FeCl2+H2↑,Fe+Fe2O3+6HCl=3FeCl2+3H2O,标况下生成672mL氢气,其物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,则反应生成氢气时消耗的Fe为0.03mol、消耗的HCl为0.03mol×2=0.06mol.由Fe原子、Cl原子守恒可知,n(Fe元素)=n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.3L×1mol/L=0.15mol.
A.混合物只有Fe、Fe2O3时,Fe的物质的量达极大值,由Fe元素守恒可知,混合物中n(Fe)=0.03mol+(0.15mol-0.03mol)×$\frac{1}{3}$=0.07mol,混合物只有Fe、FeO时,Fe的物质的量达极小值,混合物中n(Fe)=0.03mol,故混合物中铁单质物质的量的范围:0.03 mol<n(Fe)<0.07 mol,故A正确;
B.最后得到的为FeCl2溶液,加入NaOH溶液开始生成氢氧化亚铁,然后氢氧化亚铁被氧化为氢氧化铁,象为白色沉淀转化为灰绿色最后变为红褐色,故B正确;
C.由方程式Fe+2HCl=FeCl2+H2↑、Fe+Fe2O3+6HCl=3FeCl2+3H2O,可知n(Fe)>n(Fe2O3),故C错误;
D.最后得到的为FeCl2溶液,溶液中的Fe2+与Cl-的物质的量之比为1:2,故D正确;
故选C.
点评 本题考查混合物的计算,题目难度中等,关键是明确发生的反应,注意掌握极端法在化学计算中的应用,试题培养学生的分析理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+H2(g)?CH3CH2CH2CH3(g)△H1
(g)+H2(g)?CH3CH2CH2CH3(g)△H1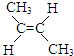 (g)+H2(g)?CH3CH2CH2CH3(g)△H2
(g)+H2(g)?CH3CH2CH2CH3(g)△H2| 温度(℃) | 300 | 320 | 340 |
| K1 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| K2 | 8.4×105 | 3.5×103 | 1.6×103 |
 (g)→
(g)→ (g)△H
(g)△H
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制作航天服的聚脂纤维是新型无机非金属材料 | |
| B. | 肥皂可以用来去油污 | |
| C. | 金属的腐蚀属于物理变化 | |
| D. | 煤的气化属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
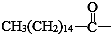 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的( )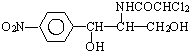
| A. | 无味氯霉素的分子式为:C27H44O6N2Cl2 | |
| B. | 它的水溶性变差,所以苦味消失 | |
| C. | 它是棕榈酸的盐类 | |
| D. | 它的水溶性变良,所以苦味消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
如图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是
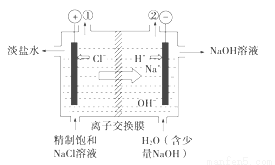
A.装置出口①处的物质是氯气
B.出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C.装置中发生的反应的离子方程式2Cl ﹣+2H+
﹣+2H+ Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com