
【题目】化合物 M 结构如图所示。对化合物 M 的叙述错误的是
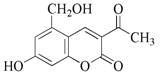
A.M 的分子式为 C12H10O5
B.M 只能与溴水发生加成反应
C.1mol M 最多可和 5mol H2 发生加成反应
D.1molM 最多可消耗 3molNaOH
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、![]() 、NO、
、NO、![]() 是污染空气和水的有害气体,如何合理利用这些有害气体是当今科学研究的方向之一.下面是一些研究方案.
是污染空气和水的有害气体,如何合理利用这些有害气体是当今科学研究的方向之一.下面是一些研究方案.
方案一:转化成无害气体.涉及的反应如下.
反应Ⅰ:![]()
反应Ⅱ:![]()
(1)反应![]() 的
的![]() ________
________![]() .
.
(2)一定条件下,将![]() 与CO以物质的量之比为
与CO以物质的量之比为![]() 置于恒容密闭容器中发生反应Ⅱ,下列能说明反应一定达到平衡状态的是________.
置于恒容密闭容器中发生反应Ⅱ,下列能说明反应一定达到平衡状态的是________.
![]() 每消耗
每消耗![]() 的同时生成
的同时生成![]()
![]() 容器中混合气体密度保持不变
容器中混合气体密度保持不变
![]() 与CO的物质的量之比保持不变
与CO的物质的量之比保持不变
![]() 混合气体颜色保持不变
混合气体颜色保持不变
![]() 混合气体的平均相对分子质量保持不变
混合气体的平均相对分子质量保持不变
(3)向容积为2L的恒容密闭容器中分别充入![]() 和
和![]() ,发生反应
,发生反应
Ⅱ![]() 在不同温度下测定反应相同时间时
在不同温度下测定反应相同时间时![]() 的转化率
的转化率![]() ,结果如图所示.
,结果如图所示.
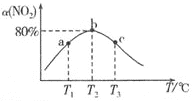
![]() 、c两点反应速率大小关系为
、c两点反应速率大小关系为![]() ________
________![]() 填或“
填或“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 温度为
温度为![]() 时,反应从开始经过
时,反应从开始经过![]() 达到b点,用
达到b点,用![]() 表示这段时间内的平均反应速率为________,此温度下该反应的平衡常数为________
表示这段时间内的平均反应速率为________,此温度下该反应的平衡常数为________![]() 若在此温度下,保持容器的容积不变,b点时再向容器中充入
若在此温度下,保持容器的容积不变,b点时再向容器中充入![]() 和
和![]() ,
,![]() 的平衡转化率将________
的平衡转化率将________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() .
.
![]() 的转化率随温度升高先增大后减小的原因是________.
的转化率随温度升高先增大后减小的原因是________.
方案二:用次氯酸钠处理废水中的氨,使其转化为氮气除去.涉及的反应为![]() .
.
(4)上述反应中HClO来自次氯酸钠溶液,原理是________![]() 用离子方程式表示
用离子方程式表示![]() .
.
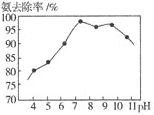
(5)实验测得废水pH与氨去除率的关系如图所示.pH较大时,氨去除率下降的原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中H2、I2各1mol·L-1进行反应H2+ I2![]() 2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
A. 小于30sB. 等于30sC. 大于30sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚀刻铜制线路板的蚀刻液种类很多:酸性蚀刻液,如![]() 蚀刻溶液、H2O2-盐酸及CuCl2-盐酸
蚀刻溶液、H2O2-盐酸及CuCl2-盐酸![]() 碱性蚀刻液,如
碱性蚀刻液,如![]() 溶液等。回答下列问题:
溶液等。回答下列问题:
(1)写出下列蚀刻液蚀刻铜的离子方程式。
①FeCl3溶液:_______。
②H2O2-盐酸:_______。
③![]() 溶液:_______
溶液:_______![]() 生成
生成![]() 。
。
(2)利用废![]() 蚀刻液
蚀刻液![]() 含
含![]() 、
、![]() 及
及![]() 制备碱性蚀刻液
制备碱性蚀刻液![]() 溶液和
溶液和![]() 的主要步骤包括:用
的主要步骤包括:用![]() 氧化废蚀刻液,通入氨气
氧化废蚀刻液,通入氨气![]() ,固液分离,用盐酸溶解沉淀和
,固液分离,用盐酸溶解沉淀和![]() 的制备。下列实验装置不能达到实验目的的是_______
的制备。下列实验装置不能达到实验目的的是_______![]() 填字母
填字母![]() 。
。
A. 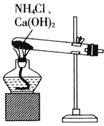 制备
制备![]()
B. 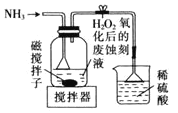 制备
制备![]() 并沉铁
并沉铁
C. 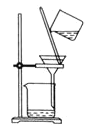 分离
分离![]() 溶液和
溶液和![]() 沉淀
沉淀
D. 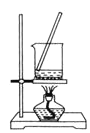 将
将![]() 溶液蒸干制备
溶液蒸干制备![]()
(3)常用水合肼![]() 还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
(4)文献报道一种回收蚀刻废液中铜并制取胆矾![]() 的主要工艺流程如下:
的主要工艺流程如下:
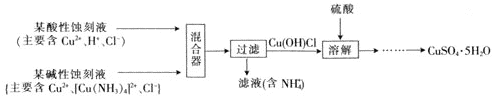
已知:![]() 易与酸反应。
易与酸反应。
![]() 在混合器中,
在混合器中,![]() 的离子方程式为_______。
的离子方程式为_______。
![]() 溶于硫酸的离子方程式为_______。
溶于硫酸的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO![]() +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO![]() ═SO
═SO![]() +2HCO
+2HCO![]()
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO![]() ═CO2↑+H2O
═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D. 中W和Y都满足8电子稳定结构
中W和Y都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学科学研究中,物质发生化学反应的反应热可通过实验测定,也可通过化学计算的方式间接地获得。
(1)实验方法测反应反应热
①中和热测定
实验中所需要使用的玻璃仪器除烧杯、量筒外还需要___、___。
为了减少实验误差:实验过程中将NaOH溶液___(选填“一次”或“分多次”)倒入盛有盐酸的小烧杯中;溶液混合后,准确读取混合溶液的___,记为终止温度。
②实验测定在一定温度下,0.2molCH4(g)与足量H2O(g)完全反应生成CO2(g)和H2(g)吸收33kJ的热量。该反应的热化学方程式___。
(2)通过化学计算间接获得
①已知拆开1mol的H—H键、I—I、H—I键分别需要吸收的能量为436kJ、153kJ、299kJ。则反应H2(g)+I2(g)=2HI(g)的反应热△H=___kJ·mol-1
②工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ·mol-1。
已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-241.8 kJ·mol-1
O2(g)=H2O(g) △H=-241.8 kJ·mol-1
根据上述反应确定:H2燃烧热为___kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com