
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
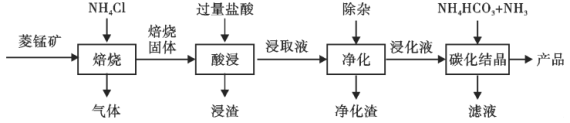
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
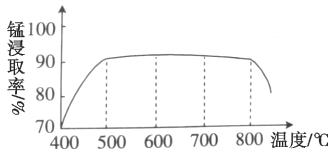
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
【答案】500℃ 温度过高,NH4Cl分解导致与MnCO3的反应不彻底(或MnCO3分解发生其他副反应;或MnCl2挥发导致Mn损失;或高温下锰被氧化成高价态造成浸取率低;或高温使固体烧结,固体表面积减小等) 将Fe2+氧化为Fe3+ MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O 4.7 Fe(OH)3、Al(OH)3 F- 与H+ 结合形成弱电解质HF,CaF2(s)![]() Ca2+(aq)+F—(aq)平衡向右移动 )Mn2++HCO3-+NH3===MnCO3↓+NH4+
Ca2+(aq)+F—(aq)平衡向右移动 )Mn2++HCO3-+NH3===MnCO3↓+NH4+
【解析】
(1)由图示得到,500 ℃时,锰的浸取率已经很大;温度很高时,氯化铵受热分解、MnCO3分解发生其他副反应等;
(2)①加入二氧化锰的目的是为了将Fe2+氧化为Fe3+;
②加氨水调溶液pH的目的是使溶液中Fe3+和Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀除去;
③若溶液酸度过高,F- 与H+ 结合形成弱酸HF,使CaF2溶解平衡向右移动;
(3)碳化结晶是氯化锰溶液与碳酸氢铵和氨水应得到碳酸锰沉淀。
(1)由图示得到,500 ℃时,锰的浸取率已经很大,所以选取500℃即可,没有必要选择更高的温度,因为温度越高,能耗越大;温度很高时,浸取率下降,有可能是高温下氯化铵分解使反应的量减少;或生成的氯化锰转化为气体离开体系;或高温下发生副反应,锰转化为其他化合物;或高温使固体烧结,固体表面积减小等,故答案为:500℃;温度过高,NH4Cl分解导致与MnCO3的反应不彻底(或MnCO3分解发生其他副反应;或MnCl2挥发导致Mn损失;或高温下锰被氧化成高价态造成浸取率低;或高温使固体烧结,固体表面积减小等);
(2)①加入二氧化锰的目的是为了将Fe2+氧化为Fe3+,反应的化学方程式为MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O;
②加氨水调溶液pH的目的是使溶液中Fe3+和Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀除去,由题给表格数据可知,溶液的pH范围调节在4.7~8.1之间时,Fe3+和Al3+完全沉淀,而Mn2+不沉淀,故答案为:4.7;
③加入MnF2目的是沉淀除去Ca2+,CaF2在溶液中存在溶解平衡CaF2(s)![]() Ca2+(aq)+F—(aq),若溶液酸度过高,F- 与H+ 结合形成弱酸HF,F—浓度减小,溶解平衡向右移动,使Ca2+沉淀不完全,故答案为:F- 与H+ 结合形成弱电解质HF,CaF2(s)
Ca2+(aq)+F—(aq),若溶液酸度过高,F- 与H+ 结合形成弱酸HF,F—浓度减小,溶解平衡向右移动,使Ca2+沉淀不完全,故答案为:F- 与H+ 结合形成弱电解质HF,CaF2(s)![]() Ca2+(aq)+F—(aq)平衡向右移动;
Ca2+(aq)+F—(aq)平衡向右移动;
(3)碳化结晶是向氯化锰溶液中加入碳酸氢铵和氨水,反应得到碳酸锰沉淀,反应的化学方程式为Mn2++HCO3-+NH3===MnCO3↓+NH4+,故答案为:Mn2++HCO3-+NH3===MnCO3↓+NH4+。


科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 序号 | 试剂X |
ⅰ | 1 mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是______(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是____________,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为___________ 。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
① 方案一:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式__________。
② 请你设计方案二:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3.60gNaCl、NaHCO3和Na2CO3的混合固体,加热足够长时间后,固体质量剩余3.29g;将剩余固体溶于一定体积的盐酸中,产生0.448L气体(标准状况下),并将所得溶液稀释至100mL,测得所得溶液pH=1。下列判断正确的是( )
A.混合固体中NaHCO3的质量为0.84g
B.混合固体中Na2CO3的质量为2.12g
C.所加盐酸中,HCl的物质的量为0.04mol
D.最终所得溶液中c(Cl-)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向密闭容器中充入等物质的量的NO和CO,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。当上述化学反应达到平衡时,下列叙述正确的是( )
N2(g)+2CO2(g)。当上述化学反应达到平衡时,下列叙述正确的是( )
A.CO2和CO的物质的量一定相等
B.NO和CO2的物质的量一定相等
C.反应物的转化率达到了该条件下的最大限度
D.平衡时混合物的总物质的量一定等于反应开始前混合物的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取硝基苯的主要步骤如下:
①将配制好的浓硫酸与浓硝酸的混合酸,冷却后加入试管中。
②向混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③水浴加热发生反应。
④反应结束后,待混合液冷却后转移至分液漏斗中,除去混合酸,粗产品依次用蒸馏水和10%的Na2CO3溶液洗涤,再用蒸馏水洗涤,得粗硝基苯。
⑤将粗硝基苯用无水CaCl2干燥后蒸馏得到纯硝基苯。

回答下列问题:
(1)配制一定比例浓硫酸和浓硝酸的混合酸的操作是___。
(2)步骤③中,水浴加热的优点是___。
(3)图中长玻璃导管的作用是___。
(4)写出制取硝基苯的化学方程式:___。
(5)步骤④中粗产品用10%的Na2CO3溶液洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.稀硫酸有酸性,可用于除去铁锈
B.Al2O3具有两性,可用于电解冶炼铝
C.SO2能使酸性高锰酸钾溶液褪色,可用于漂白有色物质
D.甲醛溶液能使蛋白质发生变性,可用于动物标本的防腐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.Na2S2O3与H2SO4溶液混合产生22.4 L气体时转移电子数为2NA
B.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
C.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
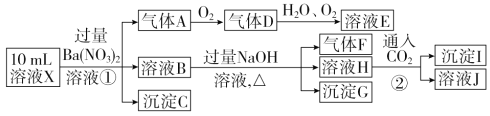
下列说法正确的是
A. X中一定存在Fe2+、Al3+、NH4+、SO42-
B. 溶液E和气体F能发生化学反应
C. X中肯定不存在CO32-、SO32-、Al3+
D. 沉淀I只有Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com