
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.Na2S2O3与H2SO4溶液混合产生22.4 L气体时转移电子数为2NA
B.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
C.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
【答案】B
【解析】
A.未指明气体的状态,无法确定22.4L气体的物质的量是1mol,则反应中转移电子的数目不一定是2NA,故A错误;
B.环丙烷和丙烯分子中均含有9个共用电子对,则标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为![]() ×9NA=9NA,故B正确;
×9NA=9NA,故B正确;
C.CH3COONH4为弱酸弱碱盐,醋酸根离子和铵根离子均会水解,因此1L溶液中CH3COO-与NH4+的数目均小于0.5NA,故C错误;
D.Na与50g质量分数为46%的乙醇溶液反应时,钠先和水反应,后再和乙醇反应;50g46%的乙醇溶液中含有的乙醇的质量为23g,物质的量为0.5mol,故和钠反应生成0.25mol氢气;而水的质量为27g,物质的量为1.5mol,故和钠反应生成0.75mol氢气,故共生成1mol氢气即NA个氢气分子,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】氮元素的化合价与其形成物质类别的关系如图所示。下列说法错误的是( )
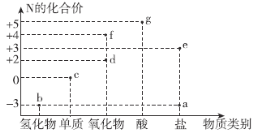
A.b与O2在一定条件下反应可以生成d
B.c既有氧化性,又有还原性
C.f的化学式一定为NO2
D.g与b可化合生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
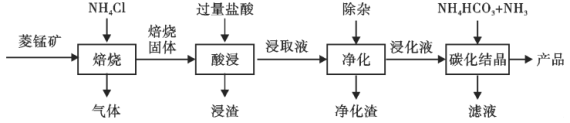
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
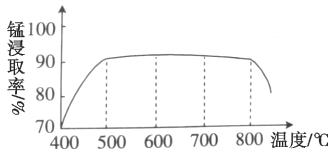
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为__,3d能级上的未成对的电子数为__。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为__,提供孤电子对的成键原子是__。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是__;氨是__分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__。
(3)单质铜及镍都是由__键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是__。
(4)某镍白铜合金的立方晶胞结构如图所示。
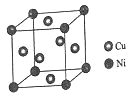
①晶胞中铜原子与镍原子的数量比为__。
②若合金的密度为dg/cm3,晶胞参数a=__nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:

回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
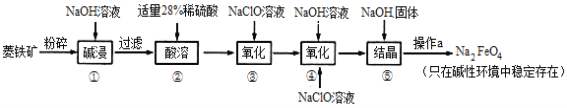
(1)Na2FeO4中铁元素的化合价为______,高铁酸钠用于杀菌消毒时的化学反应类型为_________(填“氧化还原”、“复分解”或“化合”)反应。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是______________________________________________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还需要______(填字母序号)。
A.容量瓶 B.烧杯 C.圆底烧瓶 D.玻璃棒
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________________已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_________。
(5)理论上,每获得0.5 mol的FeO42-消耗NaClO的总质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的反应:3H2 (g)+N2 (g) ![]() NH3 (g),达到限度的标志是( )
NH3 (g),达到限度的标志是( )
A.H2、N2、NH3的分子个数之比为3:1:2B.N2的正反应速率和逆反应速率相等
C.反应已经停止D.单位时间内生成3mol H2,同时生成1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
A. 将茶叶灼烧成灰,选用①②⑨
B. 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④⑥⑦
C. 过滤得到滤液,选用④⑤⑦
D. 检验滤液中的Fe3+,选用③⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料,由A制备聚丙烯酸甲酯(有机玻璃主要成分)和肉桂酸的合成路线(部分反应条件略去)如下图所示:
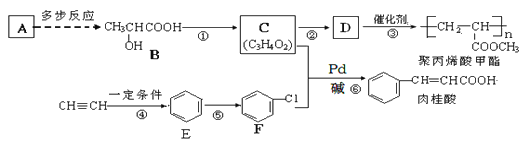
已知:![]() +CH2=CH-R
+CH2=CH-R![]() +HX(X为卤原子,R为取代基)
+HX(X为卤原子,R为取代基)
回答下列问题:
(1)反应①的反应条件是_______;⑥的反应类型是_____。
(2)B的名称为_______________________________;
(3)由C制取D的化学方程式为__________。
(4)肉桂酸的同分异构体中能同时满足下列条件:①苯环上有两个取代基且苯环上的一氯代物有两种②能发生银镜反应,③能与FeCl3溶液发生显色反应。请写出符合上述要求物质的结构简式:________。
(5)已知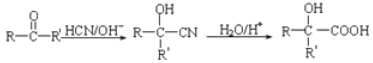 由A制备B的合成路线如下(其中部分反应条件已省略):
由A制备B的合成路线如下(其中部分反应条件已省略):
CH2=CH2→X ![]() Y→Z
Y→Z![]()
![]()
则X→Y反应方程式为______________, Z的结构简式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com