
【题目】下列溶液中离子浓度关系的表示正确的是( )
A. 在0.1 mol·L-1 KHC2O4溶液中:c(K+)+c(H+)=c(HC2O![]() )+c(OH-)+c(C2O
)+c(OH-)+c(C2O![]() )
)
B. 0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
C. 0.1 mol·L-1的NH4NO3溶液中:c(NO![]() )>c(H+)>c(NH
)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D. 物质的量浓度相等的HCOOH和HCOONa溶液等体积混合后的溶液中:2c(Na+)=c(HCOO-)+c(HCOOH)
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】【2015天津卷】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:

回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3 )42+,反应中H2O2 的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3 )42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度

(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用如图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4 溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015浙江卷】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
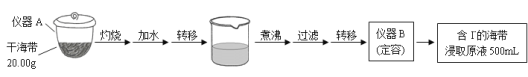
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
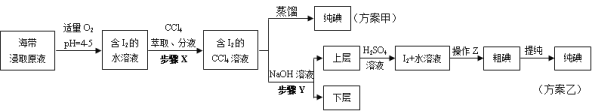
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A , 仪器 B 。
(2)①根据表中数据绘制滴定曲线:
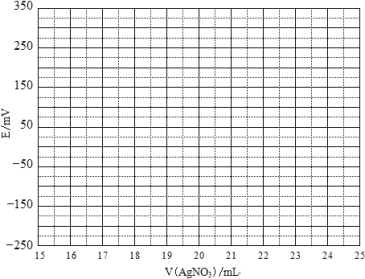
②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为 。
②步骤X中,萃取后分液漏斗内观察到的现象是 。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、P均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体, 易溶于XZ2,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是

A. 原子半径:W B. W与X组成的化合物中只含有极性键
C. 简单氢化物的沸点:Y D. 非金属性:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 向5mL 0.005mol·L-1 FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1 mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。请回答:
(一) KMnO4的制备,分步骤I、II两步进行。
步骤I.先利用下图所示装置制备K2MnO4

(1)装置A应选用______________(填a、b或c)。
(2)装置B中所盛试剂的名称为_________________。
(3)装置C处反应生成K2MnO4的化学方程式为_____________________。
步骤II.由K2MnO4制备KMnO4。已知: K2MnO4易溶于水,水溶液呈墨绿色。
主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的MnO2;
③将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥,得KMnO4晶体。
(4)过程②向滤液中通入足量CO2,可观察到的现象为____________________;
该步反应中氧化剂与还原剂的物质的量之比为_______________。
(二) KMnO4的性质
巳知: KMnO4具有强氧化性,可与草酸(H2C2O4)反应。
(5)写出KMnO4酸性溶液与草酸反应的离子方程式 _______________________。
(6)基于(5)的反应原理,探究浓度对化学反应速率的影响。
可供选择的试剂有:①0.01 mol·L-1 1 KMnO4酸性溶液;②0.3 mol·L-1 KMnO4酸性溶液;③0.1 mol·L-1 H2C2O4溶液;④0.2 mol·L-1 H2C2O4溶液
所选试剂为______(填序号);简要描述所设计的实验方案______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是( )
A. 1-丙醇与浓氢溴酸反应: CH3CH2 CH2OH + HBr ![]() CH3CH2 CH2Br + H2O
CH3CH2 CH2Br + H2O
B. 服用阿司匹林过量出现水杨酸(![]() )中毒反应, 可静脉注射 NaHCO3溶液:
)中毒反应, 可静脉注射 NaHCO3溶液:
![]() + 2 HCO3-→
+ 2 HCO3-→![]() + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D. 向丙氨酸钠中加入足量盐酸:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com