
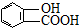 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥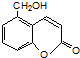

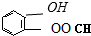 、
、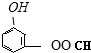 、
、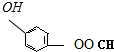
 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2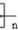 OH.
OH. 分析 (1)萃取溴水中的溴可发生褪色,能使酸性高锰酸钾褪色说明是含的α氢的苯的同系物,由此分析解答;
(2)羧基能与碳酸氢钠反应;
(3) 含有酯基;
含有酯基;
(4)能发生银镜反应,含-CHO;遇FeCl3溶液显紫色,含酚-OH;酚羟基、HCOO-能与氢氧化钠反应;
(5)石碳酸是苯酚.
解答 解:(1)甲苯既能使溴水褪色,也能使酸性高锰酸钾褪色,故答案为:①;
(2)羧基能与碳酸氢钠反应,方程式 ,故答案为:④;
,故答案为:④; ;
;
(3) 含有酯基,与足量氢氧化钠溶液共热反应的方程式
含有酯基,与足量氢氧化钠溶液共热反应的方程式 ,故答案为:
,故答案为: ;
;
(4)能发生银镜反应,含-CHO;遇FeCl3溶液显紫色,含酚-OH;酚羟基、HCOO-能与氢氧化钠反应,可能结构有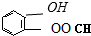 、
、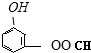 、
、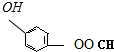 ,故答案为:
,故答案为: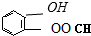 、
、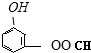 、
、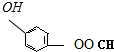 ;
;
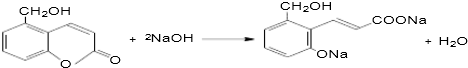
(5)石碳酸是苯酚,结构简式 ;聚乙二酸乙二酯结构简式H0
;聚乙二酸乙二酯结构简式H0 OCOCOOCH2CH2
OCOCOOCH2CH2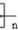 OH,故答案为:
OH,故答案为: ;H0
;H0 OCOCOOCH2CH2
OCOCOOCH2CH2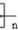 OH.
OH.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查羧酸和、酯、酚的性质,注意酯基水解生成的酚羟基也能和氢氧化钠反应,为易错点.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 | |
| B. | 钠和钾的合金常温下是固体,可用于快中子反应堆作热交换剂 | |
| C. | 碳酸氢钠是焙制糕点所用的发酵粉之一,也可以用于治疗胃酸过多 | |
| D. | 热的碳酸钠溶液可以去除物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A配置0.10mol/LNaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | 配制0.10mol/L NaOH溶液 | |
| B. | 除去CO中的CO2 | |
| C. | 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 记录滴定终点读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CN-)<c(HCN) | B. | c(HCN)+c(CN-)═0.04 mol/L | ||
| C. | c(OH-)═c(H+)+c(HCN) | D. | c(Na+)>c(CN-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.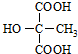 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4am/b | B. | 22.4b/am | C. | 22.4bm/a | D. | 22.4a/bm |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com