
【题目】现有42.4g由Fe、Al、Al2O3组成的混合物,将固体混合物分成两等份,将其中一份加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g;将另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,欲使该反应后溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A. 300mL B. 600mL C. 800mL D. 900mL
【答案】C
【解析】
将42.4g由Fe、Al、Al2O3的混合物分成两等份,其中一份为21.2g加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g即Fe的质量为5.6g,则设混合物中Al、Al2O3的物质的量分别为x、y,所以有27g/mol×x+102g/mol×y=15.6g![]() ①;
①;
另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,
Fe+H2SO4=FeSO4+H2↑, 2Al+3H2SO4=Al2(SO4)3+3H2↑,
0.1mol 0.1mol x ![]() x
x
Al2O3+3H2SO4=Al2(SO4)3+3H2O,
y 3y
所以有:0.1+ ![]() x=
x=![]() mol
mol![]() ②;联立①②方程,解得x=0.2mol,y=0.1mol。
②;联立①②方程,解得x=0.2mol,y=0.1mol。
由反应式可知,反应后溶液中含有0.1molFe2+、0.4molAl3+,剩余的H+为:2mol/L×0.6L×2-0.1mol×2-0.2mol×3-0.1mol×3×2=1.0mol,
欲使该反应后溶液中的金属离子完全沉淀,加入3mol/LNaOH溶液,发生的反应有:
H++OH-=H2O,Fe2++2OH-=Fe(OH)2↓,Al3++3OH-=Al(OH)3↓,
1.0mol 0.1mol 0.4mol
需要NaOH的物质的量为:1.0mol+0.1mol×2+0.4mol×3=2.4mol,
需要NaOH溶液的体积是![]() =0.8L=800mL。
=0.8L=800mL。
答案选C。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
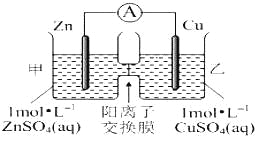
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为:
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu2O能与稀硝酸反应:Cu2O+HNO3→Cu(NO3)2+NO↑+H2O(未配平),若生成的NO在标况下的体积为0.448L,下列说法正确的是
A. 转移的电子总数为0.06NA
B. 作氧化剂的HNO3是0.14mol
C. 至少需要0.5mo/L的硝酸140mL与Cu2O反应
D. 被氧化的Cu2O是144g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,下图是该香料的一种合成路线。
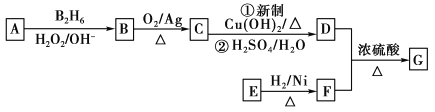
已知:
①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F
②R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下列问题:
(1)用系统命名法命名有机物B:__________。
(2)E的结构简式为__________。
(3)C与新制Cu(OH)2反应的化学方程式为______________________________________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________________
(5)已知有机物甲符合下列条件:①为芳香族化合物②与F互为同分异构体③能被催化氧化成醛。
符合上述条件的有机物甲有_________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1的有机物的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
A. 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3,其中c(CO32-)的大小关系为:②>④>③>①
B. pH=2 的H2C2O4溶液与pH=12 的NaOH 溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C. 向0.2mo/L 的NaHCO3 溶液中加入等体积0.1mo/L 的NaOH 溶液:c(CO32- )>c(HCO3-)>c(OH-)>c(H+)
D. 常温下,等浓度的CH3COOH与CH3COONa 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
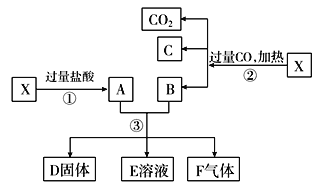
(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象的记录不正确的是( )
A.钠可以在氯气中燃烧,产生白色的烟
B.红热的铜丝可以在氯气中燃烧,生成红棕色的烟
C.纯净的氢气可以在氯气中安静燃烧,发出苍白色火焰
D.氯气作用于干燥的品红试纸,试纸不褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com