
【题目】有机物G(分子式为C13H18O2)是一种香料,下图是该香料的一种合成路线。
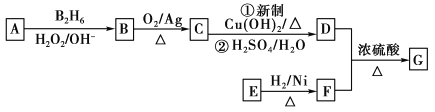
已知:
①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F
②R—CH=CH2![]() R—CH2CH2OH
R—CH2CH2OH
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链
回答下列问题:
(1)用系统命名法命名有机物B:__________。
(2)E的结构简式为__________。
(3)C与新制Cu(OH)2反应的化学方程式为______________________________________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________________
(5)已知有机物甲符合下列条件:①为芳香族化合物②与F互为同分异构体③能被催化氧化成醛。
符合上述条件的有机物甲有_________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1的有机物的结构简式为______________。
【答案】 2-甲基-1-丙醇 ![]()
![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O 在一支洁净的试管中取稀AgNO3溶液少许,边振荡试管边逐滴滴加稀氨水,至产生的沉淀恰好溶解为止 13
+Cu2O↓+3H2O 在一支洁净的试管中取稀AgNO3溶液少许,边振荡试管边逐滴滴加稀氨水,至产生的沉淀恰好溶解为止 13 
【解析】试题分析:由题中合成路线可知,B氧化为C的条件是醇的催化氧化条件,而C到D的反应条件中有醛类发生氧化的条件和酸化的条件,所以D为羧酸。又知F是苯甲醇的同系物,D和F发生酯化反应是G,由G的分子式可知,D为一元羧酸,D的相对分子质量为88,去掉1个﹣COOH剩余部分的相对质量为88﹣45=43,则![]() =3余7,则D的分子式为C4H8O2。由D的分子式并且结合G的分子式C13H18O2可知,F分子式为C9H12O。D的核磁共振氢谱显示只有3组峰,则D为(CH3)2CHCOOH,由D逆推可知C为(CH3)2CHCHO、B为(CH3)2CHCH2OH,结合信息②可知A为(CH3)2C=CH2。有机物E能够发生银镜反应,且1molE能够与2molH2完全反应生成F,且F环上只有一个无支链的侧链,则E的结构简式为
=3余7,则D的分子式为C4H8O2。由D的分子式并且结合G的分子式C13H18O2可知,F分子式为C9H12O。D的核磁共振氢谱显示只有3组峰,则D为(CH3)2CHCOOH,由D逆推可知C为(CH3)2CHCHO、B为(CH3)2CHCH2OH,结合信息②可知A为(CH3)2C=CH2。有机物E能够发生银镜反应,且1molE能够与2molH2完全反应生成F,且F环上只有一个无支链的侧链,则E的结构简式为![]() ,F为
,F为![]() ,则G为
,则G为![]() ,
,
(1)用系统命名法命名有机物B:2-甲基-1-丙醇。
(2)E的结构简式为![]() 。
。
(3)C与新制Cu(OH)2反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为:在一支洁净的试管中加入稀AgNO3溶液少许,边振荡试管边逐滴滴加稀氨水,直至产生的沉淀恰好溶解为止 。
(5)有机物甲符合下列条件:①为芳香族化合物,说明甲分子中有苯环;②与F(![]() )互为同分异构体;③能被催化氧化成醛,说明甲分子中有羟基,且羟基的
)互为同分异构体;③能被催化氧化成醛,说明甲分子中有羟基,且羟基的![]() 至少有2个。若甲的苯环上含有1个取代基为﹣CH(CH3)CH2OH,有1种;若含有2个取代基,则可能为﹣CH2CH3和﹣CH2OH,或者﹣CH3和﹣CH2CH2OH,各有邻、间、对3种排列方式,共有6种;若含有3个取代基,则可能为﹣CH2OH和2个﹣CH3,2个﹣CH3处于邻位时,﹣CH2OH有2种位置;2个﹣CH3处于间位时,﹣CH2OH有3种位置;2个﹣CH3处于对位时,﹣CH2OH只有1种位置。综上所述,甲的结构共有13种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1的有机物的结构简式为
至少有2个。若甲的苯环上含有1个取代基为﹣CH(CH3)CH2OH,有1种;若含有2个取代基,则可能为﹣CH2CH3和﹣CH2OH,或者﹣CH3和﹣CH2CH2OH,各有邻、间、对3种排列方式,共有6种;若含有3个取代基,则可能为﹣CH2OH和2个﹣CH3,2个﹣CH3处于邻位时,﹣CH2OH有2种位置;2个﹣CH3处于间位时,﹣CH2OH有3种位置;2个﹣CH3处于对位时,﹣CH2OH只有1种位置。综上所述,甲的结构共有13种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1的有机物的结构简式为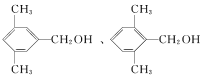 。
。


科目:高中化学 来源: 题型:
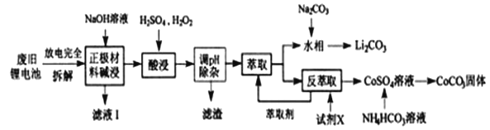
【题目】钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mo/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)滤液I的主要成分是_________。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是________不能用盐酸代替硫酸,原因是:__________。“调节pH”除去的离子主要有Al3+和_____。
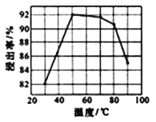
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是_________。
(4)“萃取”和“反萃取“可简单表示为:Co2++2(HA)2![]() Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
Co(HA2)2+2H+,则反萃取过程加入的试剂X是____________。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有较广泛的抑菌作用,结构简式为![]() 。下列有关说法中正确的是
。下列有关说法中正确的是
A. 该物质可以发生水解反应
B. 可以用酸性高锰酸钾溶液检验碳碳双键
C. 1 mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1∶2
D. 1 mol咖啡酸可与4 mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有42.4g由Fe、Al、Al2O3组成的混合物,将固体混合物分成两等份,将其中一份加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g;将另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,欲使该反应后溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A. 300mL B. 600mL C. 800mL D. 900mL
查看答案和解析>>
科目:高中化学 来源: 题型:
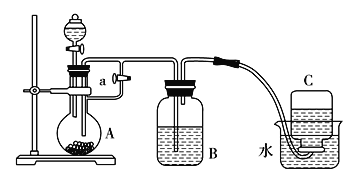
【题目】如图所示装置可用来制取Fe(OH)2并观察其在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol/L 的稀硫酸,其他试剂任选。
请完成下列问题:
(1)B装置中盛有一定量的NaOH溶液,A装置中应预先加入的试剂是________,A装置中反应的离子方程式是______________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述制取Fe(OH)2的操作过程:______________________________________________。
(4)实验完毕,拔去B装置中的橡胶塞,放入一部分空气,此时B装置中发生反应的化学方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com