



科目:高中化学 来源: 题型:
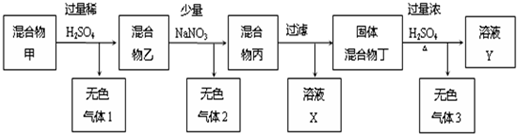
查看答案和解析>>
科目:高中化学 来源: 题型:
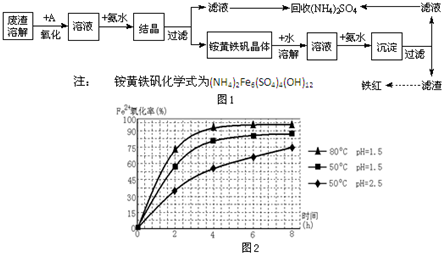 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1:
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1:查看答案和解析>>
科目:高中化学 来源: 题型:
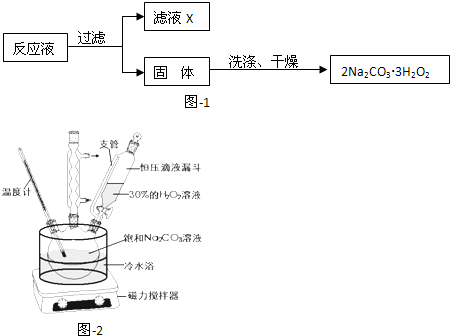
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有 | ① ② ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
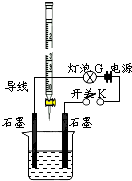 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | 2.0 | 0.03 |
| 雨后 | 2.2 | 0.01 |
| 晴 | 23.0 | 0.015 |
| 晴 | 0.9 | 0.03 |
| 在微生物的作用下 |
| +O2+H2O |
| O | 2 4 |
| 在微生物作用下 |
| +O2+H+ |
| O3 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |
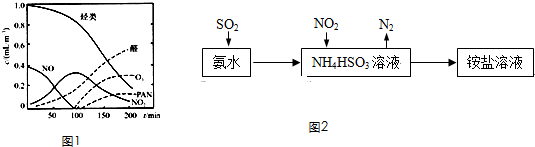
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片做负极发生氧化反应 |
| B、锌片做负极发生氧化反应 |
| C、铜片做阳极发生还原反应 |
| D、锌片做阴极发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com