
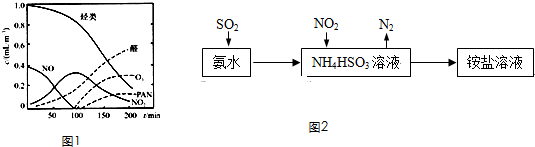
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | 2.0 | 0.03 |
| 雨后 | 2.2 | 0.01 |
| 晴 | 23.0 | 0.015 |
| 晴 | 0.9 | 0.03 |
| 在微生物的作用下 |
| +O2+H2O |
| O | 2 4 |
| 在微生物作用下 |
| +O2+H+ |
| O3 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |
| 1000×80% |
| 120 |
| 4 |
| 6.67 |
| 22.4×2 |
| X |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
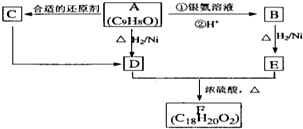
| A、该有机物属于烃 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液:Ca2+、H+、Cl-、HSO3 - | ||
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 - | ||
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3 - | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② |
| D、NaHCO3溶液中:c(Na+)>c( HCO3-)>c(OH-)>c(H+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此反应物的总能量低于生成物的总能量 |
| B、反应达到平衡后,3ν正(NH3)=2ν逆(H2O) |
| C、其它条件不变,温度越高,氨的转化率越高 |
| D、寻找合适的催化剂是加快反应速率的有效措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=0.1 mol/(L?min) |
| B、v(N2)=0.1 mol/(L?min) |
| C、v(N2)=0.2 mol/(L?min) |
| D、v(NH3)=0.3 mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com