
| A、无色溶液:Ca2+、H+、Cl-、HSO3 - | ||
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 - | ||
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3 - | ||
D、
|
| Kw |
| C(H+) |
| Kw |
| C(H+) |


科目:高中化学 来源: 题型:
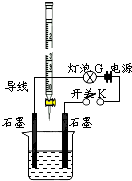 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
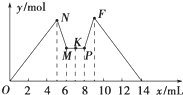 如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )| A、N点时溶液中的溶质只有NaCl |
| B、M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C、c(NaOH)=c(HCl) |
| D、原混合溶液中c(MgCl2):c(AlCl3)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | 2.0 | 0.03 |
| 雨后 | 2.2 | 0.01 |
| 晴 | 23.0 | 0.015 |
| 晴 | 0.9 | 0.03 |
| 在微生物的作用下 |
| +O2+H2O |
| O | 2 4 |
| 在微生物作用下 |
| +O2+H+ |
| O3 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |
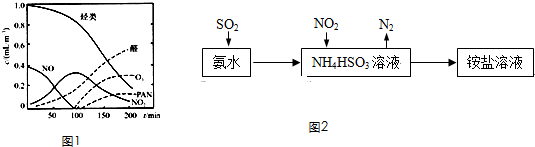
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| B、c(ClO-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(HCO3-)>c(ClO-)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率HCl>CH3COOH |
| B、气泡逸出速率CH3COOH>HCl |
| C、在相同条件下两酸产生的CO2的体积不相同 |
| D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、③⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,水由气态变为液态 |
| B、2H2(g)+O2(g)═2H2O(g) |
| C、HCl(g)+NH3(g)═NH4Cl(s) |
| D、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com