
【题目】分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
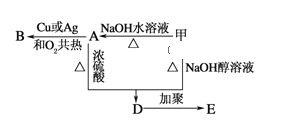
(1)若B能发生银镜反应,试回答下列问题.
①有机物甲的结构简式为_____;
②用化学方程式表示下列转化过程:
甲→A:___________________
B和银氨溶液反应:_________
(2)若B不能发生银镜反应,请回答下列问题:
①A的结构简式为__________;
②用化学方程式表示下列转化过程.甲+NaOH![]() D:_____,D→E:_____.
D:_____,D→E:_____.
【答案】 CH3CH2CH2Br ; CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr CH3CH2CHO+2Ag(NH3)2OH
CH3CH2CH2OH+NaBr CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+3NH3+2Ag↓+H2O CH3CH(OH)CH3 CH3CHBrCH3+NaOH
CH3CH2COONH4+3NH3+2Ag↓+H2O CH3CH(OH)CH3 CH3CHBrCH3+NaOH![]() CH3CH=CH2↑+NaBr+H2O nCH3CH=CH2
CH3CH=CH2↑+NaBr+H2O nCH3CH=CH2![]()
![]()
【解析】本题考查有机物推断,为高频考点,明确有机物的官能团性质及其物质之间的转化是解题的关键,注意卤代烃发生水解反应和消去反应时反应条件及断键方式区别。
若B能发生银镜反应,说明B含有醛基,A发生水解反应生成醇,B发生氧化反应生成醛,则甲的结构简式为CH3CH2CH2Br,A的结构简式为CH3CH2CH2OH,B的结构简式为CH3CH2CHO,甲或A发生消去反应都生成D为丙烯,D发生加聚反应生成E![]() 。(1) ①根据以上分析,可知甲的结构简式为CH3CH2CH2Br;②甲→A的方程式为:CH3CH2CH2Br+NaOH
。(1) ①根据以上分析,可知甲的结构简式为CH3CH2CH2Br;②甲→A的方程式为:CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr;B和银氨溶液反应的方程式为:CH3CH2CHO+2Ag(NH3)2OH
CH3CH2CH2OH+NaBr;B和银氨溶液反应的方程式为:CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+3NH3+2Ag↓+H2O(2)若B不能发生银镜反应,则B为酮,则B为CH3COCH3,A为CH3CHOHCH3,甲为CH3CHBrCH3,D为CH2=CHCH3,E为
CH3CH2COONH4+3NH3+2Ag↓+H2O(2)若B不能发生银镜反应,则B为酮,则B为CH3COCH3,A为CH3CHOHCH3,甲为CH3CHBrCH3,D为CH2=CHCH3,E为![]() 。①A的结构简式为CH3CH(OH)CH3;②甲和氢氧化钠的醇溶液在加热条件下发生消去反应生成丙烯,反应方程式为CH3CHBrCH3+NaOH
。①A的结构简式为CH3CH(OH)CH3;②甲和氢氧化钠的醇溶液在加热条件下发生消去反应生成丙烯,反应方程式为CH3CHBrCH3+NaOH![]() CH3CH=CH2↑+NaBr+H2O。 丙烯发生加聚反应生成聚丙烯,反应方程式为: nCH3CH=CH2
CH3CH=CH2↑+NaBr+H2O。 丙烯发生加聚反应生成聚丙烯,反应方程式为: nCH3CH=CH2![]()
![]() 。
。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣
B. 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣
C. 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣
D. 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1)燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
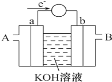
使用时,空气从_______口通入(填“A”或“B”);
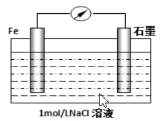
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则正极的电极反应式为:_________________,当导线中有3.01×1023个电子流过,被腐蚀的铁元素为_______g。[ 提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2 ]
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
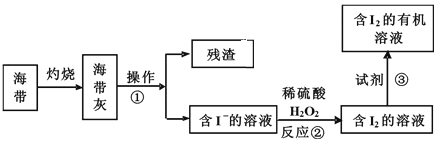
①中操作的名称是_______;下述物质中不可做试剂③的是________。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在空气中燃烧生成二氧化碳和水,下列说法正确的是( )
A.断裂H-O键放出能量B.形成H-O键吸收能量
C.该反应是放热反应D.该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会火炬是以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷。下列说法不正确的是
A.丙烷完全燃烧的产物是二氧化碳和水
B.火炬燃料用丙烷比用煤油更环保
C.铝柄有一层致密的氧化膜可防止其腐蚀
D.丙烷的燃烧是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末,其中含有SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质。二氧化铈(CeO2)是一种重要的稀土氧化物,某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)第①步反应的化学方程式是___________________________________________________,
检验滤渣A是否洗净的方法是____________________________________________________。
(2)第②步反应的离子方程式是___________________________________________________。
(3)萃取是分离稀土元素的常用方法,化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来。实验室进行萃取操作需要用到分液漏斗,分液漏斗在使用前需要进行的操作是________;TBP是一种磷酸三丁酯,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(4)取上述流程中得到的Ce(OH)4产品0.5 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗20.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是
A. 质子数为17、中子数为20的氯原子:2017ClB. 次氯酸的结构式:H-Cl-O
C. 氯分子的电子式:![]() D. 氯乙烯分子的结构简式:H3C—CH2Cl
D. 氯乙烯分子的结构简式:H3C—CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的H+浓度为1×10-12 mol·L-1的溶液:Na+、Fe2+、Cl-、NO3-
B. 能使pH试纸变深蓝色的溶液:Na+、AlO、S2-、CO![]()
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 加入活泼金属Al能产生H2的溶液:K+、NH、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com