
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末,其中含有SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质。二氧化铈(CeO2)是一种重要的稀土氧化物,某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)第①步反应的化学方程式是___________________________________________________,
检验滤渣A是否洗净的方法是____________________________________________________。
(2)第②步反应的离子方程式是___________________________________________________。
(3)萃取是分离稀土元素的常用方法,化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来。实验室进行萃取操作需要用到分液漏斗,分液漏斗在使用前需要进行的操作是________;TBP是一种磷酸三丁酯,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(4)取上述流程中得到的Ce(OH)4产品0.5 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗20.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________(保留小数点后一位)。
【答案】Fe2O3+6HCl=2FeCl3+3H2O 取最后一次洗涤液,滴加KSCN溶液,若不出现红色,则已洗净,反之,未洗净 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 检查是否漏液 上口倒出 83.2%
【解析】
(1)根据含有成分,Fe2O3为碱性氧化物,与HCl反应:Fe2O3+6HCl=2FeCl3+3H2O,SiO2为酸性氧化物,不与盐酸反应,根据流程图CeO2残留在滤渣A中,CeO2不与盐酸反应;滤渣表面杂质为HCl和FeCl3等,因此检验滤渣是否洗净,需要检验Fe3+是否存在即可,操作:取最后一次洗涤液,滴加KSCN溶液,若不出现红色,则已洗净,反之,未洗净;(2)滤液B中得到Ce3+,废玻璃粉中CeO2中的Ce化合价为+4价,CeO2为氧化剂,H2O2为还原剂,离子方程式为2CeO2+H2O2+6H+=2Ce3++4H2O+O2↑;(3)分液漏斗使用时,先检验是否漏液;TBP为酯,是密度小于水且不溶与水的液体,分液后在上层,因此应从上口倒出;(4)根据得失电子数目守恒,因此有20×10-3×0.1×1=n[Ce(OH)4]×1,解得n[Ce(OH)4]=2×10-3mol,m[Ce(OH)4]=2×10-3×208g=0.416g,则该产品的质量分数为0.416/0.5×100%=83.2%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | 97 | 64.7 | 与水互溶 |
水合肼 (N2H4H2O) | 51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | 17 | 12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):

①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
③图中X处连接的最合适装置应为下图中的_________。

(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
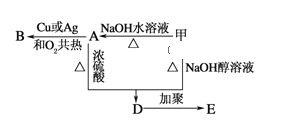
(1)若B能发生银镜反应,试回答下列问题.
①有机物甲的结构简式为_____;
②用化学方程式表示下列转化过程:
甲→A:___________________
B和银氨溶液反应:_________
(2)若B不能发生银镜反应,请回答下列问题:
①A的结构简式为__________;
②用化学方程式表示下列转化过程.甲+NaOH![]() D:_____,D→E:_____.
D:_____,D→E:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体。

请回答下列问题:
(1)写出A和C的名称或化学式: A ,C ;
(2)在上图D→C的过程中,D表现出强 (填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+1/2O2(g) ![]() CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是______(填字母)。
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是______(填字母)。
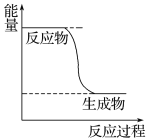
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C===O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速率v(H2)=________________,则CH3OH的转化率为___________。
Ⅱ.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
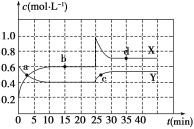
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示)______________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是___________。
Ⅲ.当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的正极为________,负极的电极反应式为_______________________________。当反应中收集到标准状况下224 mL气体时,消耗的a电极质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家用铪和钨两种核素精确确定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据18272Hf(铪-182)和18274W(钨-182)两种核素的含量比例得出的。下列有关铪-182和钨-182的关系说法正确的是( )
A. 中子数相等 B. 互为同位素
C. 原子质量几乎相同 D. 在周期表中处于相邻位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是

A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com