
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | 97 | 64.7 | 与水互溶 |
水合肼 (N2H4H2O) | 51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | 17 | 12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):

①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
③图中X处连接的最合适装置应为下图中的_________。

(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
【答案】2NO2 + 2H+ = NO↑+ NO2↑+ H2OCH3ONO + N2H4 + NaOH =(箭头也行)NaN3 + CH3OH + 2H2O或 CH3ONO + N2H4H2O + NaOH =(箭头也行)NaN3 + CH3OH + 2H2O球形冷凝管冷凝回流,平衡气压20℃冷水浴 或 缓慢通入气体等C①④②③ 或 ②④③DAgNO3溶液显酸性,且见光易分解BCD
【解析】
(1) 步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体,其中一种气体在空气中可以转化为产物中的另一种气体,说明两种气体分别为一氧化氮和二氧化氮,则离子方程式为: 2NO2 + 2H+ = NO↑+ NO2↑+ H2O; 步骤Ⅱ中CH3ONO在氢氧化钠和肼反应生成NaN3,从后面的流程分析,产物还有甲醇,反应方程式为:CH3ONO + N2H4 + NaOH =NaN3 + CH3OH + 2H2O或 CH3ONO + N2H4H2O + NaOH =NaN3 + CH3OH + 2H2O。 (2) ①仪器a为球形冷凝管。该冷凝管的作用为冷凝回流,平衡气压。②实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,所以要控制反应的温度尽量在20℃左右,或使反应慢慢进行,减少因反应放热温度的升高,故答案为: 20℃冷水浴或缓慢通入气体等。③X应连接冷凝管且应为直形冷凝管,不能用球形冷凝管,避免产物的残留,故选C。(3)步骤Ⅱ中制备叠氮化钠的操作打开K1通入亚硝酸甲酯,打开K2与大气相通,并使由于反应热而变成气体的反应物冷凝成液体流回烧瓶,同时要关闭K3,故选①;步骤Ⅲ中溶液A进行蒸馏的合理操作为关闭K1、K2,打开K3,对烧瓶进行加热,顺序是④②③ 或 ②④③。(4) ①根据亚硝酸甲酯的物理性质中能溶于乙醇、乙醚,水合肼与水或醇互溶,不溶于乙醚和氯仿,所以应选项乙醇对产品进行洗涤,故选D。 ②AgNO3溶液显酸性,且见光易分解,所以选择使用棕色的酸式滴定管。A.在滴定终点是,滴定管管尖可接触锥形瓶内壁,可使滴定管流出的液体充分反应,故错误;B.滴定时滴液速度应先快后慢,接近终点时一滴一摇,保证准确控制滴定终点,故正确;C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下,使溶液间充分反应,准确确定滴定终点,故正确;D.若未等滴定管液面稳定就读数,滴定终点读数变大,则滴定消耗的体积变大,会导致测定结果偏高,故正确;E.若发现AgNO3溶液滴加过量,不可回滴样品溶液,滴定的数据错误,实验作废,故错误。故选BCD。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图,下列说法正确的是
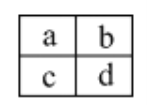
A. a、c两元素的最高正价一定相等
B. 原子半径大小顺序为:c>d>b>a
C. a、b两元素可能形成多种共价化合物
D. c、d二种元素气态氢化物的稳定性比较:c > d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案(已知:AlN+NaOH+H2O===NaAlO2+NH3↑)。
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
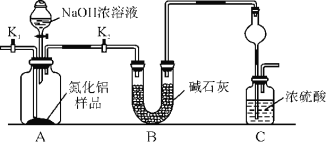
(1)上图C装置中球形干燥管的作用是_________。
(2)完成以下实验步骤:组装好实验装置,首先检查气密性,再加入实验药品,接下来的实验操作是______________________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见:_________________________。
(方案2)用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
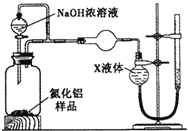
(4)为测定生成气体的体积,量气装置中的X液体可以是__________。
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(方案3)按以下步骤测定样品中AlN的纯度:
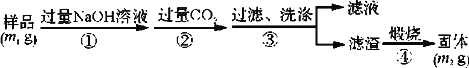
(5)步骤②生成沉淀的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣
B. 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣
C. 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣
D. 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A. NaN3中只含有离子键
B. 1 mol NaN3完全分解最多可以产生33.6L N2
C. 当有4.2g N2生成时,转移电子数约为6.02×1022
D. 常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入到盛有氯化镁溶液的试管里,不可能观察到的现象是 ( )
A.熔成小球并在液面上游动
B.有气体生成
C.溶液底部有银白色物质生成
D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L-1H3PO4溶液中加入NaOH的过程中各种微粒的物质的量分数随pH的变化关系如图所示(H3PO4)的三级电离常数依次为Ka1、Ka2、Ka3、pK=-lgK)。下列叙述错误的是

A. pKa1=2.16
B. 溶液呈中性时,[H2PO4-]>[HPO42-]
C. 反应PO43-+H2O![]() HPO42-+OH-的pK=1.68
HPO42-+OH-的pK=1.68
D. Na2HPO4溶液中存在[OH-]+[PO43-]=[H+]+[H2PO4-]+[H3PO4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1)燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
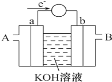
使用时,空气从_______口通入(填“A”或“B”);
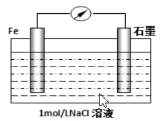
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则正极的电极反应式为:_________________,当导线中有3.01×1023个电子流过,被腐蚀的铁元素为_______g。[ 提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2 ]
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
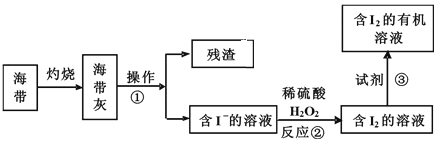
①中操作的名称是_______;下述物质中不可做试剂③的是________。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末,其中含有SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质。二氧化铈(CeO2)是一种重要的稀土氧化物,某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)第①步反应的化学方程式是___________________________________________________,
检验滤渣A是否洗净的方法是____________________________________________________。
(2)第②步反应的离子方程式是___________________________________________________。
(3)萃取是分离稀土元素的常用方法,化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来。实验室进行萃取操作需要用到分液漏斗,分液漏斗在使用前需要进行的操作是________;TBP是一种磷酸三丁酯,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(4)取上述流程中得到的Ce(OH)4产品0.5 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗20.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________(保留小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com