
【题目】a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是

A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
【答案】D
【解析】若a、b、c均为厨房中常用的物质,a为碳酸钠,X为盐酸,碳酸钠与盐酸反应生成碳酸氢钠b,碳酸氢钠与盐酸继续反应生成氯化钠c,钠离子核外有2个电子层,氯离子核外有有3个电子层,所以氯化钠中阳离子半径小于其阴离子半径,A正确;若a为气态硫化氢,与氧气反应生成单质硫b,硫继续与氧气反应生成二氧化硫c,硫化氢与氧气直接反应生成二氧化硫,硫化氢为18个电子微粒;甲烷与氧气不完全反应生成一氧化碳b,一氧化碳与氧气继续反应生成二氧化碳c,甲烷完全燃烧直接生成二氧化碳,甲烷为10个电子的微粒;综上所述,C正确;若a为单质碳,可以燃烧生成一氧化碳b,二氧化碳c,但是和氧原子序数只差为2,不是8;若a为固态非金属单质硫,与氧气反应不能直接生成三氧化硫c;也就是说,硫原子和氧原子的原子序数虽然能够差8,但是不能满足题意要求,D错误;正确选项D。


科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末,其中含有SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质。二氧化铈(CeO2)是一种重要的稀土氧化物,某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)第①步反应的化学方程式是___________________________________________________,
检验滤渣A是否洗净的方法是____________________________________________________。
(2)第②步反应的离子方程式是___________________________________________________。
(3)萃取是分离稀土元素的常用方法,化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来。实验室进行萃取操作需要用到分液漏斗,分液漏斗在使用前需要进行的操作是________;TBP是一种磷酸三丁酯,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(4)取上述流程中得到的Ce(OH)4产品0.5 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗20.00 mL标准溶液,该产品中Ce(OH)4的质量分数为________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“凯式定氮法”测定奶粉中蛋白质的含量是由丹麦人约翰·凯达尔发明的,其原理是用强酸处理蛋白质样品,让样品当中的氮释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量。凯式定氮法步骤如下:
①样品处理:准确称取一定质量的奶粉试样置于烧瓶中,加入稀硫酸及相应催化剂,一定条件下充分反应,所得产物用水溶解并冷却后全部转移到容量瓶中定容。
②碱化蒸馏:量取一定体积容量瓶中的溶液转移至图示中的反应管中,再加入足量NaOH溶液,塞好进样口橡皮塞。通入高温水蒸气,用吸收剂吸收产生的氨气。

③滴定:向吸收氨气后的溶液中滴加指示剂,用标准盐酸溶液滴定至终点。
根据以上知识回答下列问题:
(1)样品处理的目的是_______________________________________________________。
(2)碱化蒸馏时反应的离子方程式为_____________________,冷凝管中冷却水的进水口为__________(填“A”或“B”);如何通过简单的实验确定生成的氨气全部被水蒸气蒸出并进入锥形瓶__________________。
(3)凯式定氮法测定奶粉中蛋白质的含量灵敏度高,操作简单,缺点是____________________________。
(4)当奶粉含下列杂质或出现下列错误的实验操作时,会使所测蛋白质含量值“增大”的是__________(填字母)。
A.含三聚氰胺( )
)
B.样品入口未用蒸馏水冲洗
C.第(1)步定容时俯视刻度线
D.滴定开始时仰视读数,滴定终点时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的H+浓度为1×10-12 mol·L-1的溶液:Na+、Fe2+、Cl-、NO3-
B. 能使pH试纸变深蓝色的溶液:Na+、AlO、S2-、CO![]()
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 加入活泼金属Al能产生H2的溶液:K+、NH、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到5.05g沉淀,对样品所含杂质的正确判断是
A. 肯定有Na2CO3,没有Ba(NO3)2 ,可能有有KNO3
B. 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C. 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D. 以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示的原电池,下列说法正确的是( )
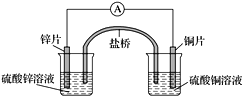
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com