
某研究小组欲探究SO2的化学性质,设计了如下实验方案。
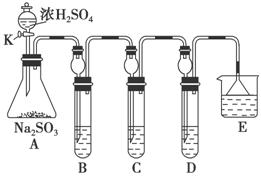
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入______ __ ______ | __________ _______ ___ ____ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
【知识点】二氧化硫的性质
【答案解析】(每空2分)
(1) 硫化氢水溶液(或硫化钠、硫氢化钠溶液)(2分)
(2) 2Fe3++SO2+2H2O===2Fe2++SO42-+4H+ (2分)
(3)(i)CaSO4 (2分)
(ii)实验操作:过量(或适量)0.5 mol•L-1HCl,塞上代导管的单孔塞,将导管另一端插入盛有少量澄清石灰水或品红溶液的试管中;
预期现象和结论: 若固体完全溶解,有气体放出,且澄清石灰水变浑浊(品红溶液褪色)则假设一成立,若固体不溶解,或溶解但无气泡或澄清石灰水未变浑浊(或品红溶液不褪色)则假设一不成立。
(iii)2SO2+2H2O+Ca(ClO)2==CaSO4↓+2HCl+H2SO4
解析:(1)硫化氢水溶液或硫化钠、硫氢化钠溶液中的硫元素都为-2价,与二氧化硫反应,化合价会升高,被氧化二氧化硫表现氧化性,如:2H2S+SO2=3S+2H2O中,H2S中S元素的化合价升高,被氧化,SO2中S元素的化合价降低,被还原,SO2为氧化剂。
(2)Fe3+具有氧化性,可将SO2氧化,离子方程式为:2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
(3)(i) CaSO3可被空气中的氧气氧化,因此另一沉淀可能为CaSO4
(ii)CaSO3可与HCl反应生成SO2,SO2可使澄清石灰水变浑浊,可使品红溶液褪色,而CaSO4不溶于HCl,没有上述现象。
(iii)Ca(ClO)2具有强氧化性,可将二氧化硫氧化为硫酸根,结合溶液中的钙离子,产生硫酸钙沉淀。
【思路点拨】本题考查无机物中二氧化硫的性质,包括了二氧化硫的氧化性与还原性及鉴别,考查内容全面,其中未知化学方程式的推断是本题的难点。


科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、N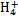 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C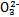 、S
、S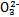 、S
、S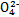 、Cl-、N
、Cl-、N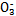 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
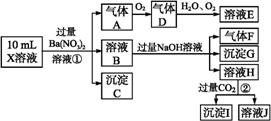
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,当沉淀C物质的量(填:“<”或“=”或“>”某个值) mol,表明不能确定是否含有的离子中一定存在 。(若不止一种可能,填一种情况即可) 
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 金属氧化物一定是碱性氧化物 |
|
| B. | 只含有一种元素的物质一定是单质 |
|
| C. | 胶体与溶液的本质区别在于是否有丁达尔现象 |
|
| D. | 化学反应中元素的化合价都没变化的为非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对盆栽鲜花施用了S-诱抗素制剂可保证鲜花盛开。S-诱抗素的分子结构如下图,
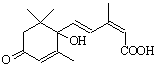 下列关于该物质的说法正确的是 ( )
下列关于该物质的说法正确的是 ( )
A.其分子式为C15H22O4
B.1 mol该物质与NaOH溶液反应,最多消耗2 molNaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序正确的是:
A、半径:Al3+>Mg2+>Na+>F– B、稳定性:HI<HBr<HCl<HF
C、酸性:HClO4<H2SO4<H3PO4 D、碱性:Al(OH)3>Mg(OH)2>Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.化学电池的放电过程就是电能转化为化学能的过程
B.化学电池中电子由正极流出,经外电路流向负极
C.燃料电池两极板均发生氧化还原反应
D.燃料电池工作时,通常是将空气通向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)  zC(g) △H<0。
zC(g) △H<0。
达到化学平衡后测得A的浓度为0.5 mol·L-1;在恒温下,将密闭容器的容积压缩至原来的二分之一,再次达到平衡时,测得A的浓度为0.9 mol·L-1。则下列叙述中正确的是
A. 平衡向正反应方向移动了 B.x+y<z
C. B的转化率下降 D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨水溶液的质量分数越大时,其溶液的密度越小,将80%和20%的两种氨水溶液等体积混合后,溶液的质量分数为( )。
A.大于50% B.等于50% C.小于50% D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com