
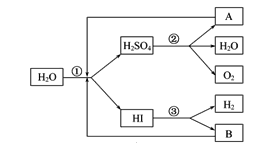
【题目】人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2和O2,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:
(1)实验测得,1 g H2燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为_______。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是____________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:①CaBr2+2H2O=Ca(OH)2+2HBr↑;②……③HgBr2+Ca(OH)2=CaBr2+HgO+H2O;④2HgO=2Hg+O2↑。反应②的化学方程式为________________________。
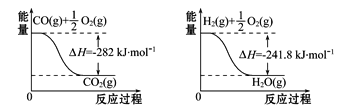
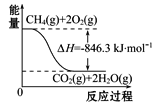
(4)合成氨用的H2可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
【答案】H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 SO2I2②Hg+2HBr=HgBr2+H2↑CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1
【解析】
(1)1g氢气燃烧生成液态水放出142.9kJ热量,则2g氢气即1mol氢气燃烧生成液态水放出285.8kJ的热量,则表示氢气燃烧的热化学方程式为H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol;综上所述,本题答案是:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1 。
(2)反应①为:二氧化硫和碘单质和水反应:SO2+I2+2H2O═H2SO4+2HI,反应②为:硫酸分解生成二氧化硫、水、氧气:2H2SO4=2SO2↑+O2↑+2H2O,反应③为:碘化氢分解2HIH2+I2,整个流程参与循环的物质是SO2、I2,最难进行的反应是②;综上所述,本题答案是:SO2 ; I2 ; ②。
(3)根据反应③知反应②有HgBr2生成,根据HgBr2知反应①的产物HBr参与反应②,所以反应②为:Hg+2HBr═HgBr2+H2↑;因此本题答案是:Hg+2HBr=HgBr2+H2↑。
(4)由三个图可写出相应的热化学方程式:CO(g)+1/2O2(g)═CO2(g) △H=-282kJmo-1①H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJmo-1②CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-846.3kJmo-1③,由盖斯定律:用“③-(①+②×3)”得所求反应的△H=+161.1kJmo-1,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+161.1 kJmol-1;综上所述,本题答案是:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+161.1 kJ·mol-1。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】如下图设计的串联电池装置,R为变阻器,以调节电路电流。
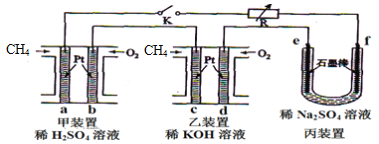
(1)写出b、c电极的电极反应式:b______________,c_______________;
(2)写出f电极的电极反应式____________________,向此电极区域滴入酚酞的现象为:_____________;该电极区域水的电离平衡被____________(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________(填“变大”、“变小”或“不变”),原因是______________。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______g H2O就可以将析出的沉淀溶解并恢复到原有浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是( )
2SO3(g) ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是( )
A. 相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B. 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出的热量为Q kJ
C. 若使用催化剂,该反应的|ΔH|减小
D. 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:________。
(2)用盐酸酸浸时,为使酸浸速率加快,可采取的一种措施是:____________________,发生反应的离子方程式为:____________________________________。
(3)流程中通过过滤得到草酸氧化钛钡晶体,过滤操作中使用的玻璃仪器有:______________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:___________________________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol·L-1,则c(CO32-)在浸出液中的最大浓度为:_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的,下图是某工厂从海水中提取镁的主要步骤。学生就这个课题展开了讨论。
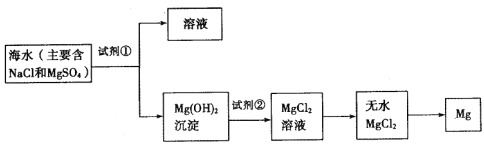
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集,有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生_______的观点正确(填学生序号),简述理由:______________________。
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,并充分利用当地的贝壳(主要成分为碳酸钙)资源,加入的足量试剂①是___________(填化学式)。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________(填标号字母)
A.蒸馏 B.过滤 C.萃取 D.分液
(3)加入的足量试剂②是______________________(填化学式)。
(4)写出由无水MgCl2制取金属镁的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知在常温常压下:
①2CH3OH(l) + 3O2 (g) = 2CO2(g) + 4H2O(g) H1= – 1276.0 kJ/mol
②2H2(g) + O2(g) = 2H2O(g) H2 = – 482.0 kJ/mol;
③H2O(g) = H2O(l) H3= – 44.0 kJ/mol
(1)写出由CO2和H2合成甲醇和液态水的热化学方程式______________________。
(2)在容积为2 L的密闭容器中,通入2mol CO2和5mol H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示;
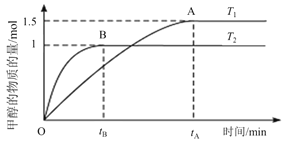
①T1 ______T2(填“<,>或=”),处于A点的反应体系从T1变到T2,达到平衡时![]() _______(填“增大,减小或不变”)。
_______(填“增大,减小或不变”)。
②若在T2温度下5 min达到化学平衡,求平衡时用H2表示的平均反应速率为![]() ______。
______。
(3)某实验小组依据甲醇燃烧的反应原理,设计下图所示的电池装置:
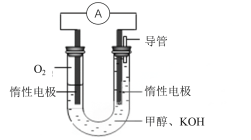
①写出电池负极的电极反应式:_____________________________________,该电池工作一段时间,测得溶液的pH________(填“增大,减小或不变”)。
②写出该电池总反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在绿色化学工艺中,理想状态是反应物原子全部转化为欲制的产物,即原子利用率为![]() 。以下反应最符合绿色化学“原子经济”要求的是( )
。以下反应最符合绿色化学“原子经济”要求的是( )
A. 乙烯聚合为聚乙烯高分子材料B. 甲烷与氯气制备一氯甲烷
C. 以铜和浓硫酸为原料生产硫酸铜D. 用二氧化硅制备高纯硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com