
【题目】如下图设计的串联电池装置,R为变阻器,以调节电路电流。
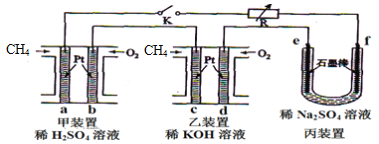
(1)写出b、c电极的电极反应式:b______________,c_______________;
(2)写出f电极的电极反应式____________________,向此电极区域滴入酚酞的现象为:_____________;该电极区域水的电离平衡被____________(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________(填“变大”、“变小”或“不变”),原因是______________。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______g H2O就可以将析出的沉淀溶解并恢复到原有浓度。
【答案】O2+4H++4e-=2H2OCH4+10OH--8e-=CO32-+7H2O2H++2e-=H2↑溶液变红促进不变硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变72
【解析】
根据图示,甲乙装置为两个燃料电池串联,丙为电解硫酸钠的装置。甲乙装置中通入甲烷的电极为负极,即a、c为负极,通入氧气的为正极,即b、d为正极,则e为阳极,f为阴极。
(1)根据上述分析,b为正极,发生还原反应,电解质为硫酸,电极反应式为O2+4H++4e-=2H2O,c电极为负极,发生氧化反应,电解质为氢氧化钾,电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:O2+4H++4e-=2H2O;CH4+10OH--8e-=CO32-+7H2O;
(2)f电极为阴极,发生还原反应,电极反应式为2H++2e-=H2↑,电解反应发生后,电极附近溶液显碱性,向此电极区域滴入酚酞,溶液变红色;氢离子浓度减小,该电极区域水的电离平衡受到促进,故答案为:2H++2e-=H2↑;溶液变红;促进;
(3)丙装置为电解硫酸钠溶液,相当于电解水,电解后电解质溶液pH不变,故答案为:不变;硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变;
(4)CH4的体积为22.4L(标准状况下),甲烷的物质的量为1mol,根据CH4+10OH--8e-=CO32-+7H2O可知,转移的电子为8mol,则丙装置中电解的水为4mol,质量为4mol×18g/mol=72g,因此需要加入72g水,可以将析出的沉淀溶解并恢复到原有浓度,故答案为:72。


科目:高中化学 来源: 题型:
【题目】A、B、C、W 均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去)。
![]()
(1)若单质 A 为黄色固体,B 为无色有刺激性气味的气体,C 能与水反应生成一种二元强酸.
①B→C 的化学方程式_____。
②向 NaOH 溶液中通入过量的气体 B 的离子方程式______。
(2)若 A 是一种黄绿色的气体,B 的饱和溶液滴入沸水中能生成红褐色胶体。
①检验 B 溶液中阳离子的常用试剂是_____。
②B 与 W 转化为 C 的离子反应方程式_____。
③一定条件下 W 与水反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A. 合成氨工业中采用高压条件
B. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C. 用排饱和食盐水的方法收集Cl2
D. 在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)

A. 13、7、1 B. 12、7、2
C. 1、7、13 D. 7、13、1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨和铵盐说法正确的是( )

A. 氨和铵盐都易溶于水,都能生成NH![]()
B. 铵盐都能与碱反应,不能与酸反应
C. 实验室制备氨气可用如图所示试剂和装置
D. 铵盐受热分解都能产生氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2和O2,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:
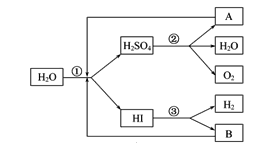
(1)实验测得,1 g H2燃烧生成液态水放出142.9 kJ的热量,则表示氢气燃烧热的热化学方程式为_______。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是____________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:①CaBr2+2H2O=Ca(OH)2+2HBr↑;②……③HgBr2+Ca(OH)2=CaBr2+HgO+H2O;④2HgO=2Hg+O2↑。反应②的化学方程式为________________________。
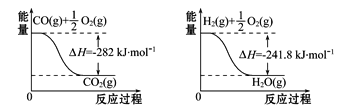
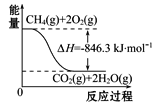
(4)合成氨用的H2可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com