
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。
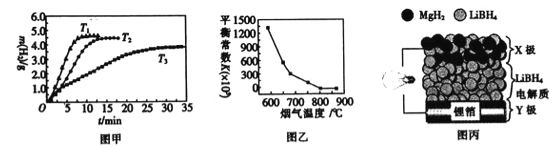
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
【答案】 [H:]- Mg2+[:H]- 2Mg2Cu+3H2=MgCu2+3MgH2 MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=-309 kJ·mol-1 T3<T2<T1 ![]() < MgH2+2Li++2e-=Mg+2LiH Li++e-=Li
< MgH2+2Li++2e-=Mg+2LiH Li++e-=Li
【解析】(1)MgH2是一种离子化合物,其电子式为[H:]- Mg2+[:H]-,故答案为:[H:]- Mg2+[:H]-;
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,反应的化学方程式为2Mg2Cu+3H2= MgCu2+3MgH2,故答案为:2Mg2Cu+3H2=MgCu2+3MgH2;
(3)①根据①MgH2(s)=Mg(s)+H2(g) △H1=+74.4kJ mol-1;
②H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
③Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
将①+②+③得:MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=(+74.4kJ mol-1)+(-241.8 kJ mol-1)+(-141.6 KJ mol-1)=-309 kJ·mol-1,故答案为:MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=-309 kJ·mol-1;
②温度越高,放出氢气的速率越快,温度由小到大的顺序为T3<T2<T1,故答案为:T3<T2<T1;
(4)①反应2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g)的平衡常数表达式为K=
2MgSO4(s)+N2(g)的平衡常数表达式为K=![]() ,故答案为:
,故答案为:![]() ;
;
②根据图像,升高温度,平衡常数减小,说明平衡逆向移动,说明正反应为放热反应,a<0,故答案为:<;
(5)根据图像,固态锂为负极,X极为正极,结合放电时的电池反应2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为MgH2+2Li++2e-=Mg+2LiH。充电时,Y极为阴极,电极反应式为Li++e-=Li,故答案为:MgH2+2Li++2e-=Mg+2LiH;Li++e-=Li。


科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
碱 | 酸 | 盐 | 酸性氧化物 | |
A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
C | 苛性钠 | 醋酸 | 石灰石 | 水 |
D | KOH | 碳酸 | 纯碱 | 三氧化硫 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是( ) ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A.①和②
B.①和③
C.③和④
D.①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质存在如下图所示的转化关系(反应条件、部分产物未标出),已知某物质X是一种正盐,E是强酸
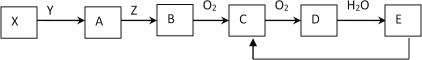
试回答下列问题:
(1)若Y为强酸,且B为黄色固体单质
①从组成物质的元素化合价变化角度预测C可能具有的性质_______________
②一定条件下E转化为C有多种途径,写出其中一种转化的化学反应方程式_______________________。
(2) 若Y为强碱,且B为空气中含量最高的气态单质
①写出实验室制取A的化学方程式______________________________________。
②若A→B的转化常用来检验Z气体管道的是否漏气,用该方法检验的现象是____________________,
其化学反应方程式_________________________________________。
③C、D都是大气污染物,它们对环境造成的危害表现在_______。
A.引起酸雨 B.引起温室效应
C.形成光化学烟雾 D.引起水体富营养化
④将x mL C、y mL D混合于同一试管中,将试管倒置于水中,同时通入z mL O2充分反应后,试管内气体全部消失,则x:y:z不可能是 _______________
A 1:1:1 B 2:1:1
C 3:7:4 D 1:5:2
(3)无论Y为强酸或强碱均符合上述转化,则物质X的化学式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活和化工、能源、材料生产密切相关,下列有关说法不正确的是
A. 吸水性高分子、医用生物高分子、导电高分子均属于功能高分子材料
B. 通过干馏,可以将煤中含有的苯等芳香烃从煤中分离出来
C. 太阳能、生物质能、风能、氢能均属于新能源
D. 用灼烧的方法可以区分蚕丝和涤纶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
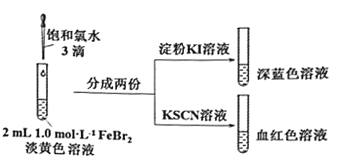
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
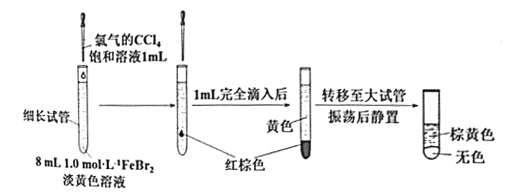
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙醇的结构简式为C2H6O
B. 苯酚和乙醇都含有羟基官能团,二者属于同一类物质
C. 实验室制乙酸乙酯用饱和Na2CO3收集
D. 烯烃含有碳碳双键不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度最大的是
A.1000mL 2.5mol/L NaCl 溶液 B.300mL 5mol/L KClO3 溶液
C.250mL 1mol/L AlCl3 溶液 D.200mL 2mol/L MgCl2 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com