
【题目】二氧化锆是重要的耐高温材料、陶瓷绝缘材料.以锆英砂(主要成分为ZrSiO4 , 还含有少量Fe2O3、Al2O3、SiO2等杂货)为原料制备二氧化锆(ZrO2)的工艺流程如图所示. 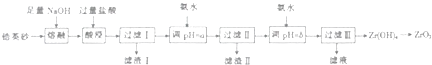 已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表
离子 | Fe3+ | AP+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(1)经熔融后,锆英砂中Zr元素以(写化学式)形式存在,写出酸浸时生成Al3+、Fe3+的离子方程式:
(2)滤渣I的主要成分的名称为
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是然后继续加氨水至pH=b的范围是
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为
【答案】
(1)Na2ZrO3;Fe2O3+6H+=Fe3++3H2O,AlO2﹣+4H+=Al3++2H2O
(2)硅酸
(3)除去Fe3+、Al3+;b≥8.0
(4)2NH4++CaCO3 ![]() Ca2++2NH3↑+CO2↑+H2O
Ca2++2NH3↑+CO2↑+H2O
【解析】解:(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3 , 其反应的方程式为:ZrSiO4+4NaOH ![]() Na2SiO3+Na2ZrO3+2H2O,经熔融后,锆英砂中Zr元素以Na2ZrO3存在,酸浸时生成Al3+、Fe3+的反应是氧化铁和酸反应生成氯化铁和水,偏铝酸钠和盐酸反应生成氯化铝和水,反应的离子方程式为:Fe2O3+6H+=Fe3++3H2O,AlO2﹣+4H+=Al3++2H2O, 所以答案是:Na2ZrO3;Fe2O3+6H+=Fe3++3H2O,AlO2﹣+4H+=Al3++2H2O;(2)加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣Ⅰ为H2SiO3 , 名称为:硅酸,所以答案是:硅酸;(3)需用氨水调pH=a,使Fe3+、Al3+转化为氢氧化物沉淀,而ZrO2+不能沉淀,根据表中数据可知:pH在5.2~6.2时Fe3+、Al3+完全沉淀,而ZrO2+不沉淀;加氨水至pH=b=8时,ZrO2+与NH3H2O反应生成Zr(OH)4沉淀,其反应的离子方程式为:ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+ , 所以b≥8.0使ZrO2+完全转化为Zr(OH)4沉淀,
Na2SiO3+Na2ZrO3+2H2O,经熔融后,锆英砂中Zr元素以Na2ZrO3存在,酸浸时生成Al3+、Fe3+的反应是氧化铁和酸反应生成氯化铁和水,偏铝酸钠和盐酸反应生成氯化铝和水,反应的离子方程式为:Fe2O3+6H+=Fe3++3H2O,AlO2﹣+4H+=Al3++2H2O, 所以答案是:Na2ZrO3;Fe2O3+6H+=Fe3++3H2O,AlO2﹣+4H+=Al3++2H2O;(2)加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣Ⅰ为H2SiO3 , 名称为:硅酸,所以答案是:硅酸;(3)需用氨水调pH=a,使Fe3+、Al3+转化为氢氧化物沉淀,而ZrO2+不能沉淀,根据表中数据可知:pH在5.2~6.2时Fe3+、Al3+完全沉淀,而ZrO2+不沉淀;加氨水至pH=b=8时,ZrO2+与NH3H2O反应生成Zr(OH)4沉淀,其反应的离子方程式为:ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+ , 所以b≥8.0使ZrO2+完全转化为Zr(OH)4沉淀,
所以答案是:除去Fe3+、Al3+;b≥8.0;(4)过滤Ⅲ所得滤液中主要含有铵根离子,溶液显酸性,加入CaCO3粉末并加热得到氨气和二氧化碳,其反应的离子方程式为:2NH4++CaCO3 ![]() Ca2++2NH3↑+CO2↑+H2O;
Ca2++2NH3↑+CO2↑+H2O;
所以答案是:2NH4++CaCO3 ![]() Ca2++2NH3↑+CO2↑+H2O.
Ca2++2NH3↑+CO2↑+H2O.


科目:高中化学 来源: 题型:
【题目】有机物H是一种香料,可从柑橘类物质中提取,它的一种合成路线如下 
已知:
①D能与碳酸氢钠溶液反应
②G核磁共振氢谱显示其分子中含有2种不同化学环境的氢原子;
③CH3CHO+CH3CHO ![]()
![]()
回答下列问题:
(1)A→B的反应类型为
(2)E的名称为F的结构简式为
(3)反应①的化学方程式为
(4)反应⑤的化学方程式为
(5)D有多种同分异构体,写出符合下列条件的D的所有同分异构体的结构简式:(不考虑立体异构) I.笨坏上含有三个取代基
Ⅱ.不能与NaHCO3溶液反应
Ⅲ.能发生银镜反应和水解反应
IV.核磁共振氢谱有4组峰
(6)参照上述合成路线,设计一条以A为原料制备  的合成路线.
的合成路线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
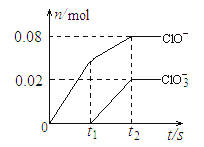
A. 苛性钾溶液中KOH的质量是5.6 g B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2 D. 一定有3.136 L氯气参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两种气体的体积如果不同,其主要原因是 ( )
A. 气体的分子大小不同
B. 气体分子间的平均距离不同
C. 气体的物质的量不同
D. 气体的性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得到相应实验结论的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Na2SO3 | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2 >Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) 
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生如图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为气体混合物,R是一种无色无味能使澄清石灰水变浑浊的气体,C为红褐色沉淀,M为一种常见金属单质。

试回答下列问题:
(1)X的化学式为__________。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的_________(填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列转化的化学方程式:
B→D:____________________;H→C:____________________。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为:___________。
(5)X与浓硝酸在一定条件下反应时,若有1 mol X被氧化时,转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的
A. 使用催化剂并不能改变反应速率B. 使用催化剂可以加快反应速率
C. 降低压强能加快反应速率D. 降温可以加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com