
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.SO2具有还原性,可用于漂白纸浆
B.MgO熔点高,可用作耐高温材料
C. KAl(SO4)2·12H2O易溶于水,可用作净水剂
D.NH4Cl受热易分解,可用作氮肥
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A含碳77.8%,氢7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。
(1)试计算确定该有机物的分子式(写出简明计算过程)。
(2)红外光谱测定,A分子结构中含有苯环和羟基。在常温下A可与浓溴水反应,1mol A最多可与2 molBr2作用,据此确定该有机物可能的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
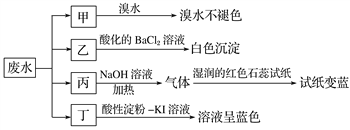
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
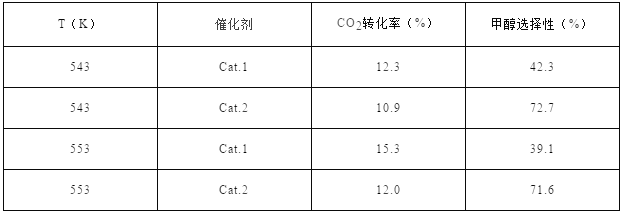
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、B、C、D为短周期元素,且只有A、D为非金属元素。A的氢化物溶于水得到的溶液能使酚酞溶液变红。B、C、D的最高价氧化物对应水化物相互之间能够两两反应,且D原子最外层电子数是C原子最外层电子数的2倍。B、E元素同主族,且原子序数相差8。
(1)E在元素周期表中的位置: 。
(2)写出金属铜与A的最高价氧化物对应水化物浓溶液反应的化学方程式: 。
(3)A的氢化物溶于水后的电离方程式为 ;实验室常用来 制备A的氢化物的化学方程式为 。
(4)B单质在空气中燃烧后的产物为 ,产物中存在的化学键类型有 ,写出该产物和水反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
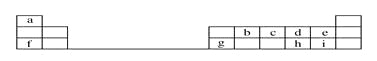
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com