
【题目】下列措施能提高合成氨[N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
①采用20 MPa~50 MPa的压强;②使用催化剂;③在合适的温度下进行反应;④从平衡混合气体中液化分离出NH3,并将N2、H2循环使用
A. ①③④ B. ③④ C. ①②③ D. 全部
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度时,化学反应速率加快原因的合理解释是
A.该化学反应的过程是吸热的
B.该化学反应的过程是放热的
C.分子运动速率加快,使反应物分子的碰撞机会增多
D.反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
Ⅰ.NO+NO2+Ca(OH)2Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成![]() ,
, ![]() 被还原为Mn2+。
被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I氧化为I2, ![]() 能将I2还原为I。
能将I2还原为I。
【制备氮氧化物】
(1)甲组同学拟利用如下图所示装置制备氮氧化物。
![]()
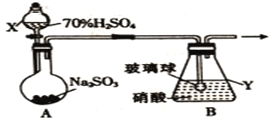
①仪器X的名称是_______________,在制备氮氧化物前要先____________________________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为____________________________________________________,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
(2)乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如图。
![]()
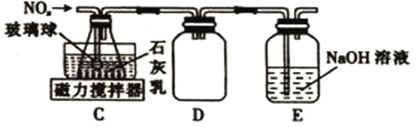
①装置C中导管末端接一多孔玻璃球的作用是______________________________________。
②装置D的作用是_______________________;装置E的作用是______________________。
【测定Ca(NO2)2的纯度】
(3)丙组同学拟用滴定法测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1 mol·L1的KI溶液 c.淀粉溶液
d.c2 mol·L1的Na2S2O3溶液 e.c3 mol·L1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是________________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取m g Ca(NO2)2样品放入锥形瓶中,加适量水溶解,加入______________________________,然后滴加稀硫酸,用c2 mol·L1的Na2S2O3溶液滴定至溶液颜色由________________________,且半分钟内不变色,读取消耗Na2S2O3溶液的体积。为减少误差,须__________________________________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题. 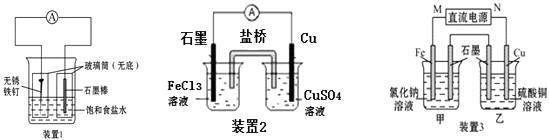
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的K闭合,下列判断正确的是
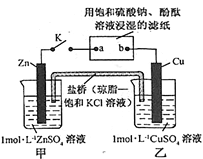
A. 片刻后甲池中c(SO42- )增大
B. 电子沿Zn→a→b→Cu路径流动
C. 片刻后乙池中c(Cu2 + )增大
D. 片刻后可观察到滤纸a点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
B. 60g丙醇中存在的共价键总数为10NA
C. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D. 235g![]() U发生裂变反应:
U发生裂变反应: ![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() U+10
U+10![]() n净产生的中子(
n净产生的中子(![]() n)数为10NA
n)数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com