
【题目】通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A. NH3 B. Cl2 C. NO D. HCl
科目:高中化学 来源: 题型:
【题目】1L 0.1mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断中正确的是( )
A.溶液的浓度变为0.08mol/L
B.阳极上产生112ml O2 (标准状况)
C.转移的电子数是1.204×1022 个
D.反应中有0.01mol Ag 被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用__________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 ___________(“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 ________( “变多”“变少”“不变”),所求中和热_______(“相等、不相等”)
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入amolCO和bmolO2,一定条件下反应后容器内碳原子数和氧原子数之比为
A. a︰b B. a︰2b C. a︰(a+2b) D. a︰2(a+2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质.充放电时的电池反应为:Li+LiMn2O4 ![]() Li2Mn2O4 . 下列说法正确的是( )
Li2Mn2O4 . 下列说法正确的是( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e﹣═Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e﹣═Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能提高合成氨[N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
①采用20 MPa~50 MPa的压强;②使用催化剂;③在合适的温度下进行反应;④从平衡混合气体中液化分离出NH3,并将N2、H2循环使用
A. ①③④ B. ③④ C. ①②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?);达到平衡时,混合气体的平均相对分子质量
3B(?)+C(?);达到平衡时,混合气体的平均相对分子质量![]() 与温度的关系如图所示,下列判断中正确的是
与温度的关系如图所示,下列判断中正确的是
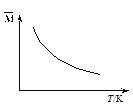
A. 若正反应吸热,则B、C可能都是气体
B. 若正反应吸热,则B、C一定都是气体
C. 若正反应放热,则B、C一定都是气体
D. 若正反应放热,则B、C可能都是固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:

①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol/L,则平衡时CO2的浓度为________mol/L。
②下列措施中能使平衡时CO物质的量百分数增大的是________(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是______。
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的v逆变化曲线_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com