
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
【答案】D
【解析】解:A、明矾净水的原理是:Al3++3H2O=Al(OH)3(胶体)+3H+ , 利用Al(OH)3(胶体)的吸附性进行净水,故A正确;
B、因为轮船主要用铁造外壳,铁在海水中易被腐蚀,镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率,故B正确;
C、氧化镁的熔点是2852℃,可用于制作耐高温材料,故C正确;
D、电解MgCl2饱和溶液,发生的化学反应为: ![]() ,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应
,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应 ![]() ,故D错误.
,故D错误.
故选:D.
【考点精析】本题主要考查了金属的电化学腐蚀与防护的相关知识点,需要掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法才能正确解答此题.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,有下列三个热化学方程式:
(i)H2(g)+ ![]() O2(g)═H2O(g)△H1=﹣Q1 kJmol﹣1
O2(g)═H2O(g)△H1=﹣Q1 kJmol﹣1
(ii)2H2(g)+O2(g)═2H2O(l)△H1=﹣Q2 kJmol﹣1
(iii)2H2(g)+O2(g)═2H2O(g)△H1=﹣Q3 kJmol﹣1
则Q1、Q2、Q3的关系表示正确的是( )
A.Q1=Q2<Q3
B.Q2>Q3>Q1
C.Q3>Q2>Q1
D.Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.电解时电解池的阳极一定是阴离子放电
C.原电池的两极一定是由活动性不同的两种金属组成的
D.原电池的负极、电解池的阳极都发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题. 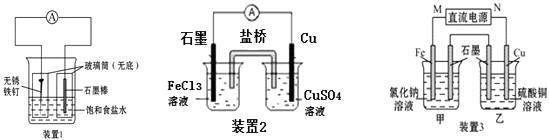
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度一定时,于密闭容器中发生可逆反应:m A(g)+n B(g)![]() p C(g),达到平衡后,若将混合气体的体积压缩到原来的1/2,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中正确的是
p C(g),达到平衡后,若将混合气体的体积压缩到原来的1/2,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中正确的是
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com