
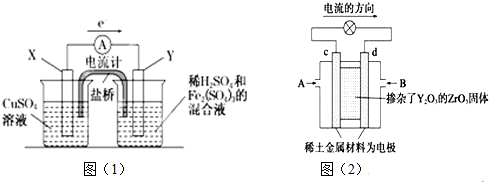
���� ��1���ٸ��ݷ���ʽ��ʧ���ӵ�������������������Ƿ�Ӧ���п����Եġ��õ��ӵ����ʣ�
��Y�缫�õ��ӵ������������Ϸ�Ӧ����Ϸ���ʽ�жϵõ��ӵ����ӣ��Ӷ�д���缫��Ӧʽ��
��2������װ��ͼ��2���е������������cΪ�����������ĵ��ӷ�����ԭ��Ӧ��dΪ����������ʧ���ӷ���������Ӧ��
��� �⣺��1����ԭ�����ʧ���ӵ����������������ݷ���ʽ֪��ͭͭʧ����������������ķǽ���̼�����������ʴ�Ϊ��Cu��̼��
��Y�缫�õ��ӵ����ʣ�̼���������������ϵõ��ӣ�������ԭ��Ӧ�����ݷ���ʽ֪��Fe3+�õ��ӣ�����Fe2+��������ӦΪ2Fe3++2e-=2Fe2+��
�ʴ�Ϊ��2Fe3++2e-=2Fe2+��
��2��ͼ��2����ԭ��أ����ݵ��������Ǵ�����������c�缫Ϊ������d�缫Ϊ��ظ�����d���ϼ���ʧ���ӷ�����ԭ��Ӧ���缫��ӦΪ��CH4-8e-+4O2-�TCO2+2H2O���ʴ�Ϊ��������CH4-8e-+4O2-�TCO2+2H2O��
���� ���⿼��ԭ��صĹ���ԭ��������ʱע�������ϵı仯��Ҫ����д�缫��Ӧʽ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
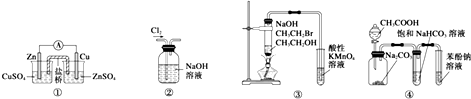
| A�� | װ�â٣�����п-ͭԭ��� | |
| B�� | װ�âڣ���ȥCl2�к��е�����HCl | |
| C�� | װ�âܣ���ʵ��������֪����ǿ��˳��ΪCH3COOH��H2CO3��C6H5OH | |
| D�� | װ�âۣ���֤�����鷢����ȥ��Ӧ����ϩ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Z | B�� | A | C�� | A+Z+1 | D�� | A-Z+1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
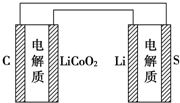 ��֪��صı������Dz���缫��Ӧ�ĵ�λ�����ĵ缫���Ϸų����ܵĴ�С���й��������ֵ��˵����ȷ���ǣ�������
��֪��صı������Dz���缫��Ӧ�ĵ�λ�����ĵ缫���Ϸų����ܵĴ�С���й��������ֵ��˵����ȷ���ǣ�������| A�� | ����ӵ�طŵ�ʱ��Li+��Ǩ�� | |
| B�� | ����س��ʱ��﮵缫������ԭ��Ӧ | |
| C�� | ���������ֵ�صı�������ͬ | |
| D�� | ��ͼ��ʾ������ӵ�ظ�����س�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
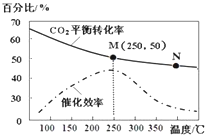
| A�� | ������ϩ�����ʣ�v��M��һ��С��v��N�� | |
| B�� | ��ѧƽ�ⳣ����KN��KM | |
| C�� | ���¶ȸ���250��ʱ�������¶ȣ�ƽ�����淴Ӧ�����ƶ����Ӷ�ʹ�����Ĵ�Ч�ʽ��� | |
| D�� | ��Ͷ�ϱ�n��H2����n��CO2��=3��1����ͼ��M��ʱ����ϩ���������Ϊ7.7% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
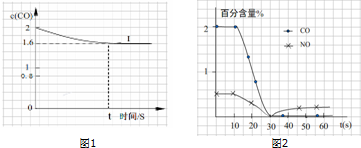
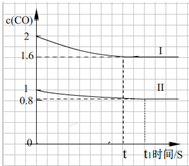 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
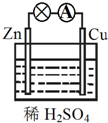
| A�� | ZnΪ������CuΪ���� | B�� | ��װ�ý���ѧ��ת��Ϊ���� | ||
| C�� | ������ӦʽΪCu-2e-�TCu2+ | D�� | ������ͭƬͨ����������пƬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ������ӦΪZn-2e-�TZn2+ | |
| B�� | ����ܷ�ӦΪZn+Cu2+�TZn2++Cu | |
| C�� | ȡ�����ţ�������ָ����Ȼƫת | |
| D�� | ���ţ����KCl������Һ���ݵ���֬���е�K+����ZnSO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
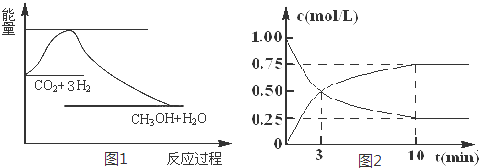
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com