
ClO2是一种高效安全的杀菌消毒剂,还可用于除去水中的CN –离子,转化为2种无毒气体。下列判断正确的是
A.ClO 2是还原剂
B.1 mol ClO 2转移3mol电子
C.CN –离子转化为NO2和CO2
D.氧化剂与还原剂的物质的量之比是1∶1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
将0.5 mol·L-1的Na2CO3溶液与amol·L-1的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断正确的是
A.c(Na+)>2c(CO32-)+c(HCO3-)+c(OH-)
B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3)
C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则可确定a>0.5
D.若c(CO32-)+2c(OH-) = 2c(H+)+c(HCO3-)+3c (H2CO3), 则可确定a=0.5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
捕碳技术是指从空气中捕获CO2的技术。目前NH3已经被用作工业捕碳剂。下列物质中不能作为捕碳剂的是
A.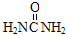 B.H2NCH2CH2NH2 C.(NH4)2CO3 D.Na2CO3
B.H2NCH2CH2NH2 C.(NH4)2CO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:填空题
(8分)铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
解释下列操作或事实的离子方程式正确的是
A.把钠投入水中:2Na+2H2O 2Na+ + 2OH- +O2↑
2Na+ + 2OH- +O2↑
B.把铜片放入氯化铁溶液中:Cu +Fe3+ Cu2+ +Fe2+
Cu2+ +Fe2+
C.铝制容器不能长期存放碱性食物:2Al + 2OH-  2AlO2- + H2↑
2AlO2- + H2↑
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2 I2+2H2O
I2+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:简答题
(14分)脱去冶金工业排放烟气中SO2的方法有多种。
(1)热解气还原法。已知CO还原SO2生成S(g)和CO2过程中, 每转移1mol电子需吸收2.0 kJ的热量,则该反应的热化学方程式为 。
每转移1mol电子需吸收2.0 kJ的热量,则该反应的热化学方程式为 。
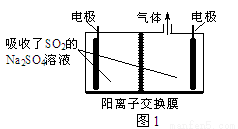
(2)离子膜电解法。利用硫酸钠溶液吸收SO2,再用惰性电极电解。将阴极区溶液导出,经过滤分离硫磺后,可循环吸收利用,装置如图1所示,则阴极的电极反应式为 ,阳极产生气体的化学式为 。
(3)氧化锌吸收法。配制ZnO悬浊液(含少量MgO、CaO) ,在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2 = ZnSO3(s),测得pH、吸收效率η随时间t的变化如图2所示。
,在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2 = ZnSO3(s),测得pH、吸收效率η随时间t的变化如图2所示。
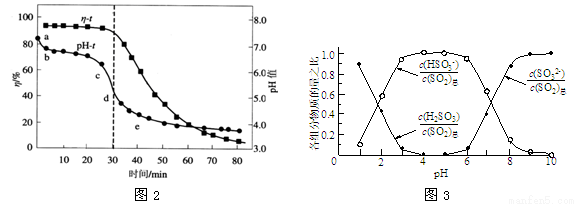
①该反应常温能自发进行的原因是 。
②纯ZnO的悬浮液pH约为6.8,结合图2和图3,下列说法正确的是 。
A.向ZnSO3与水混合体系中加稀硫酸,硫元素会以SO2形式逸出
B.pH-t曲线ab段发生的主要反应为ZnO+SO2=ZnSO3
C.pH-t曲线cd段发生的主要反应为ZnSO3+SO2+H2O = Zn (HSO3)2
D.pH=7时,溶液中c(SO32-) = c(HSO3-)
③为提高SO2的吸收效率η,可采取的措施为 。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH 至6.0以下
至6.0以下
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+
B.0.1 mol·L-1 FeCl3溶液中:Mg2+、NH4+、SCN-、SO42-
C.滴入甲基橙显黄色的溶液中: Na+、ClO-、I-、SO42-
D.水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Na+、NO3-、CH3COO-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期二模考试理综化学试卷(解析版) 题型:简答题
[化学——选修2:化学与技术](15分)水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康。请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl-和SO42-。则该硬水属于________(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加________后加________。
(2)我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10 mg CaO称为1度。某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT-(铬黑T)===MEBT+
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA)===MY2-
MEBT++Y4-(EDTA)===MY2-+EBT-(铬黑T)
实验过程:
①取地下水样品25.00 mL进行预处理。写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________________________________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是_______________________。
③将处理后的水样转移到250 mL的锥形瓶中,加入氨水—氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00 mol·L-1的EDTA标准溶液进行滴定。滴定终点时共消耗EDTA溶液15.00 mL,则该地下水的硬度为______________。
(3)某工业废水中含有CN-和Cr2O 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为_______。
②含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com