
(8分)铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三3月联考理综化学试卷(解析版) 题型:填空题
(14分)
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
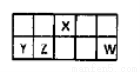
(1)写出X的原子结构示意图 。
(2)列举一个事实说明W非金属性强于Z 。
(3)含Y的某种盐常用作净水剂,其净水原理是 (用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10。处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-) c(HCN)(填“>”、“<”或“=”)。
(5)已知:
①C(s)+O2(g)===CO2(g);△H =a kJ·mol-1;
②CO2(g) +C(s)===2CO(g);△H =b kJ·mol-1;
③Si(s)+ O2(g)===SiO2(s);△H =c kJ·mol-1。
工业上生产粗硅的热化学方程式为 。
(6)已知:CO(g)+H2O(g) H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。

该反应的△H 0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为 。
(7)一种新型氢氧燃料电池工作原理如下图所示。
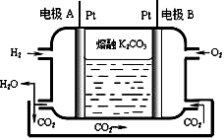
写出电极A的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:实验题
(本题共12分)乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应。
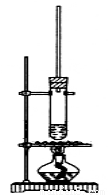
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤。
将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右。
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5. 12 g。
已知:
物质 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | 互溶 |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
完成下列填空:

(1)上图装置中长导管有冷凝回流作用,它可以由分水回流装置代替。分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去。
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用 。
使用分水器装置进行回流的可逆反应,一般应具备 条件。
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水。
预先加水的目的是 。
(3)反应时加热有利于 提高酯的产率,但温度过高时酯的产率反而降低,
其可能的原因是 。
(4)水洗的目的是 。碱洗的目的是 。
测pH值的操作 。
(5)本次实验乙酸正丁酯的产率 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是
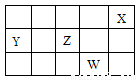
A.原子半径的大小顺序: r(W) >r(Z)> r(Y)
B.Y、Z的氢化物有可能含非极性键
C.Z、W形成的化合物W显负价
D.Y分别与Z、W形成的化合物全部都是非极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
化学学科需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2分子比例模型:
B.NH4I的电子式:
C.乙醇的结构简式:C2H5OH
D.K+最外层电子排布式:4S24P6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
ClO2是一种高效安全的杀菌消毒剂,还可用于除去水中的CN –离子,转化为2种无毒气体。下列判断正确的是
A.ClO 2是还原剂
B.1 mol ClO 2转移3mol电子
C.CN –离子转化为NO2和CO2
D.氧化剂与还原剂的物质的量之比是1∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
下列比较中不正确的是
A.金属性:K > Na > Li
B.热稳定性:HI > HCl > HF
C.非金属性:F > O > N
D.碱性:NaOH > Mg(OH)2 > Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
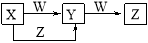
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
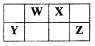
A.W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B.Z元素的最高价氧化物水化物的酸性强于Y
C.四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D.向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com