
【题目】工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C. SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D. SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
【答案】A
【解析】
将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的转化率为50%,所以反应的SO2的物质的量为1mol,因为反应是可逆反应,发生反应的二氧化硫为1mol,放热为98.3kJ,热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6 kJmol-1或SO2(g)+
2SO3(g)△H=-196.6 kJmol-1或SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=-98.3 kJmol-1;
SO3(g)△H=-98.3 kJmol-1;
A、选项中的热化学方程式符合题意,故A正确;
B、热化学方程式中反应热和对应二氧化硫的量不符合,故B错误;
C、反应是放热反应,故C错误;
D、热化学方程式中反应热和对应二氧化硫的量不符合,故D错误;
故选A。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
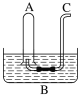
(1)将A倒插入B槽中发生反应的化学方程式为_______________________________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质的量之比为________。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L1(设溶液的体积仍为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol]:下列说法正确的是( )
2NH3(g)△H=﹣92.4kJ/mol]:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3 B. a+b>92.4 C. 2p2<p3 D. α1+α3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
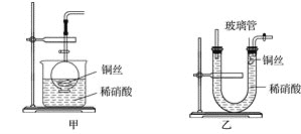
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,则下列说法不正确的是
A. 23g 钠在空气中充分燃烧,转移的电子数为NA
B. 50ml 12mol/L的盐酸与足量的MnO2共热,充分反应后,转移电子数为0.3NA
C. 0.6mol过氧化钠晶体中所含阴离子的数目为0.6NA
D. 常温常压下,8.8gN2O 和CO2混合气体所含的原子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容积的容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是( )
A. SO2为0.4 molL-1,O2为0.2 molL-1 B. SO2为0.25 molL-1
C. SO2、SO3均为0.15 molL-1 D. SO3为0.4 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-ykJ·mol-1
CO2(g)+H2(g) ΔH2=-ykJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
(1)2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
(2)下列有关合成二甲醚的说法正确的是___(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小![]() ,平衡一定向正方向移动
,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,
CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,![]() 将___(选填“增大”“减小”或“不变”)。
将___(选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比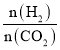 的关系如图所示。
的关系如图所示。
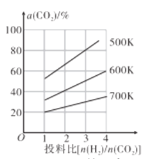
①500K时,将9molH2和3molCO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___molL-1min-l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是___(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1∶2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.金属镁与稀盐酸反应:Mg+2HCl === Mg2++2Cl-+H2↑
B.氯化钡溶液与硫酸反应:Ba2++![]() === BaSO4↓
=== BaSO4↓
C.碳酸钠溶液与盐酸反应:Na2CO3+2H+=== 2Na++CO2↑+H2O
D.盐酸与大理石反应:2H++![]() ===CO2↑+H2O
===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬(Ibuprofen)为非甾体抗炎药,具有镇痛、抗炎作用。其合成路线如下:
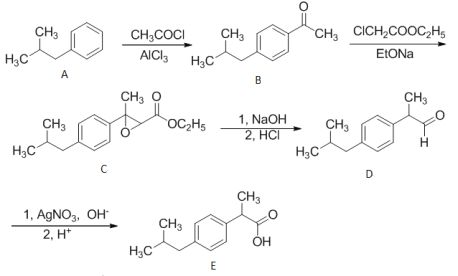
请回答下列问题:
(1)A→B的反应类型为_____ B的分子式为_____
(2)C中所含官能团的名称为________
(3)苯中混有A,除杂试剂为_________,分离方法为______
(4)检验D中官能团的化学方程式______________反应类型为_____
(5)比E少4个碳原子的E的同系物,其符合下列条件的同分异构体有___种(不考虑立体异构),其中核磁共振氢谱为五组峰的结构简式为________
①遇FeCl3溶液显紫色 ②苯环上只有两个互为对位的取代基
③1mol该物质与足量的金属钠反应产生1mol H2 ④双键碳原子上不连羟基
(6)请结合题中所给信息和所学知识以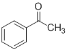 和CH3CH2OH为原料(其它无机试剂任选)合成
和CH3CH2OH为原料(其它无机试剂任选)合成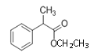 ______________。
______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com