
【题目】下列关于铝及其化合物的说法,不正确的是
A.铝是地壳中含量最多的金属元素,自然界中铝以稳定化合态存在
B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C.常温下,铝遇浓硝酸、浓硫酸时会在表面生成致密的氧化物膜而发生钝化
D.向氯化铝溶液中滴加饱和NaF溶液,再滴加氨水,振荡后,没有观察到白色沉淀
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:Fe(s)+Cu2+(aq)=Fe2+(aq)+Cu(s)设计的原电池如图所示。
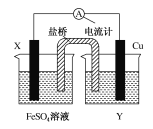
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为_______________;X电极上发生的电极反应为__________________。
(3)外电路中的电子是从________电极流向________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4,下列说法错误的是( )
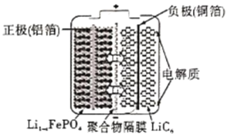
A.“刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染
B.放电时,负极反应为LiC6-xe-=xLi++Li1-xC6
C.充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌
D.该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是基本的有机化工原料,A与CO、H2O以物质的量1:1:1的比例生成B。B、C两物质中的官能团分别具有乙酸、乙醇中官能团的性质。D是有芳香味、不溶于水的油状液体。有关物质的转化关系如下:
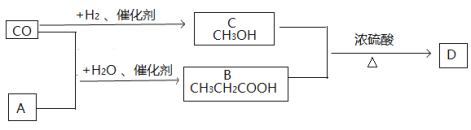
请回答:
(1)A的结构简式______________________________
(2)B + C → D的化学方程式____________________________________________________________
(3)下列说法不正确的是 ___________________
A.有机物A能使酸性高锰酸钾溶液褪色
B.有机物B与乙酸互为同系物
C.有机物B、C都能与金属钠反应,且等物质的量的B、C与足量钠反应产生氢气质量相等
D.可用NaOH溶液来除去有机物D中混有的杂质B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化产物与还原产物为同一种物质的是
A.KClO3 + 6HCl = KCl+ 3Cl2↑+ 3H2OB.2Na+2H2O=2NaOH+H2↑
C.2Na2O2+2H2O=4NaOH+O2↑D.I2+2Na2S2O3 = 2NaI + Na2S4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.将0.1 mol·L-1 CH3COOH溶液从20 ℃升温至30 ℃,溶液中c(H+)/c(CH3COOH)减小
B.若NH4Cl溶液与NH4HSO4溶液的pH相等,则c(NH![]() )也相等
)也相等
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水(含较高浓度的Br-)为原料提取溴的部分流程如下:
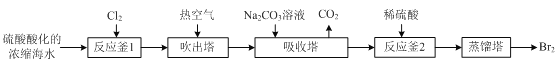
已知:3Br2+3CO32- =5Br- +BrO3- +3CO2↑。
图甲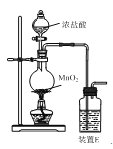 图乙
图乙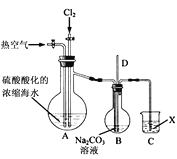
(1)反应用的Cl2可由图甲所示装置制取,制取Cl2的化学方程式为____。为除去Cl2中挥发出的HCl,装置E中所盛溶液是____。
(2)实验室用图乙所示装置模拟流程中的部分过程。
①通入Cl2时发生反应的离子方程式为____。
②通入热空气的作用是____。
③烧杯C中所盛溶液是____。
④烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是____。
(3)“反应釜2”中所发生反应的离子方程式为____。
(4)蒸馏后,蒸馏塔溶液中仍溶有少量Br2,可以向其中加入少量____萃取其中的Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器,aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.物质B的质量分数增加了B.物质A的转化率减少了
C.平衡向逆反应方向移动了D.a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com