
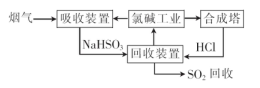
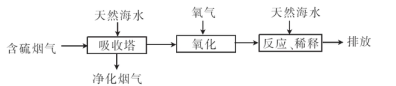
 2NaOH+H2↑+Cl2↑.溶液的主要成分是NaOH。将含SO2的烟气通入该溶液时发生反应:SO2+2NaOH=Na2SO3+H2O ;SO2过量时发生SO2+NaOH=NaHSO3。相应的离子方程式为:SO2+2OH-=SO32-+H2O;SO2+OH-=HSO3-。②由流程图可以看出:在上述流程中循环利用的物质是NaCl。(2)用氧气进行氧化处理吸收含硫的烟气后天然海水的反应原理的化学方程式是2H2SO3+O2=2H2SO4;氧化后的海水含有硫酸,水溶液显酸性,所以需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是使氢氧化钠与硫酸发生中和反应。(3)①在母液中加入石灰乳所起的作用是使Mg2+转化为Mg(OH) 2沉淀除去。②MgCl2是强酸弱碱盐,加热时盐会弱碱在结晶水中,盐发生水解反应产生Mg(OH) 2和HCl,HCl随着水分的蒸发而挥发,最后得到的是Mg(OH) 2固体。元素要利用MgCl2·6H2O制得无水氯化镁.应采取的措施是在HCl气流中脱水,来抑制MgCl2水解。③由于Mg活动性很强,在高温时容易与空气中的O2及水蒸气发生反应,也能与CO2发生反应产生MgO和C。所以要在惰性气体Ar的环境中冷却。选项为A。2造成的危害的治理方法及电解法冶炼Mg的有关问题的知识。
2NaOH+H2↑+Cl2↑.溶液的主要成分是NaOH。将含SO2的烟气通入该溶液时发生反应:SO2+2NaOH=Na2SO3+H2O ;SO2过量时发生SO2+NaOH=NaHSO3。相应的离子方程式为:SO2+2OH-=SO32-+H2O;SO2+OH-=HSO3-。②由流程图可以看出:在上述流程中循环利用的物质是NaCl。(2)用氧气进行氧化处理吸收含硫的烟气后天然海水的反应原理的化学方程式是2H2SO3+O2=2H2SO4;氧化后的海水含有硫酸,水溶液显酸性,所以需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是使氢氧化钠与硫酸发生中和反应。(3)①在母液中加入石灰乳所起的作用是使Mg2+转化为Mg(OH) 2沉淀除去。②MgCl2是强酸弱碱盐,加热时盐会弱碱在结晶水中,盐发生水解反应产生Mg(OH) 2和HCl,HCl随着水分的蒸发而挥发,最后得到的是Mg(OH) 2固体。元素要利用MgCl2·6H2O制得无水氯化镁.应采取的措施是在HCl气流中脱水,来抑制MgCl2水解。③由于Mg活动性很强,在高温时容易与空气中的O2及水蒸气发生反应,也能与CO2发生反应产生MgO和C。所以要在惰性气体Ar的环境中冷却。选项为A。2造成的危害的治理方法及电解法冶炼Mg的有关问题的知识。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.用氨水鉴别Al3+、Mg2+和Ag+ |
| B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| C.菠菜中铁元素含量较高,为证明菠菜中的铁元素是+2价还是+3价,可把菠菜捣碎加水溶解,再向过滤后的滤液中加硫氰化钾溶液 |
| D.加入稀盐酸产生使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Br- | B.SO42- | C.H2SO3 | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 | 说明该钠盐是硫酸钠或硫酸氢钠 |
| B | 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 | 得到较纯净的乙酸乙酯 |
| C | 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 | 说明汽油中含有甲苯等苯的同系物 |
| D | 向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 目的 | 分离方法 |
| A | 提取NaCl溶液中的碘单质 | 乙醇萃取 |
| B | 分离乙酸乙酯和饱和Na2CO3溶液 | 分液 |
| C | 除去NaCl固体中的NH4Cl | 加热 |
| D | 除去Cl2中的HCl | 饱和食盐水洗气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②一⑥一④一①一③一⑤ | B.②一①一⑥一③一④一⑤ |
| C.②一①一③一⑥一⑤一④ | D.②一③一①一⑥一⑤一④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为________ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | ③________________ __________________ __________________ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在________ |
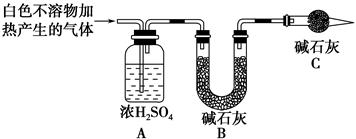
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+:加NaOH溶液,加热,滴入酚酞溶液检验所得溶液 |
| B.CO32-:加入稀盐酸,产生无色能使澄清石灰水变浑浊的气体 |
| C.Fe3+:加入KSCN溶液,溶液呈血红色 |
| D.Cl-:加入AgNO3溶液,产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com