

 .
.分析 (1)依据热化学方程式和盖斯定律计算分析;
(2)反应Ⅱ吸热反应,依据反应自发进行的判断依据是△H-T△S<0分析;
(3)①不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度影响CO2平衡转化率变化的趋势曲线分析可知,
②反应Ⅲ是放热反应,升温平衡逆向进行;
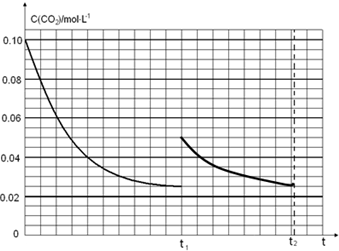
(4)图象分析二氧化碳的平衡浓度为0.025mol/L,体积缩小一半浓度增大一倍应为0.05mol/L,随反应进行达到平衡状态,因为生成物为固体,最后达到相同平衡状态,二氧化碳浓度不变,据此画出变化曲线;
(5)分析尿素结构可知,和羰基连接的氨基据此性质分析推断.
解答 解:(1)反应Ⅰ:2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a kJ•mol-1
反应Ⅱ:NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1
总反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1
由盖斯定律总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a=-159.47kJ•mol-1,
故答案为:-159.47 kJ•mol-1;
(2)反应Ⅱ:NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行,
故答案为:>;高温;
(3)①反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,
故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)?NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为: ,
,
故答案为: ;
;
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O?(NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连,能够与水反应生成铵根离子,所以选项中符合此结果特征的有类似性质,
A.NH2COONH4 ,结构中含有与羰基连接的氨基,故A符合;
B.H2NOCCH2CH2CONH2 结构中含有与羰基连接的氨基,故B符合;
C.HOCH2CH2OH,结构中不含有氨基,故C不符合;
D.HOCH2CH2NH2,分子中的氨基不是和羰基连接,不具有此性质,故D不符合;
故答案为:AB.
点评 本题考查较为综合,涉及热化学方程式和盖斯定律的计算应用、化学平衡影响因素分析判断、平衡常数,图象绘制与分析等知识,题目难度较大,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及应用,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
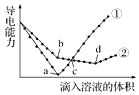 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | c点,两溶液中含有相同量的OH- | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | ①代表滴加H2SO4溶液的变化曲线 | |
| D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加入铝粉能产生氢气的溶液中:Fe2+、K+、NO3-、Cl- | |
| B. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| C. | 含有大量Al3+的溶液中:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=1的溶液:Na+、ClO-、K+、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3化肥结块后可以用木棒敲击砸碎后再使用 | |
| B. | 染发剂有植物染发剂、无机染发剂、合成染发剂等 | |
| C. | 常用洗涤剂的主要成分是表面活性剂 | |
| D. | 有机磷农药比有机氯农药易分解,在环境中残留时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 开始时左右两室分子数相同 | B. | 最终容器内无H2存在 | ||
| C. | 反应前后H2室压强相同 | D. | 最终容器内密度与原来相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com