
分析 (1)结合n=$\frac{m}{M}$、c=$\frac{n}{V}$及稀释前后溶质的物质的量不变计算,配制溶液需要玻璃棒、容量瓶等;
(2)3Cl2+6KOH(浓)═5KCl+KClO3+3H2O中,Cl元素失去电子被氧化,Cl元素的得到电子被还原,3molCl2参加该反应时,只有1molCl作还原剂,结合化合价计算转移电子;
(3)①还原过程的反应式为NO3-+4H++3e-→NO+2H2O,则具有还原性的物质可使还原反应发生,据此判断反应物及生成物;
②根据①的方程式判断硝酸在反应中体现的性质.
解答 解:(1)n(MgCl2)=$\frac{9.5g}{95g/mol}$=0.1mol,c(MgCl2)=$\frac{0.1mol}{0.1L}$=1mol/L,c(Cl-)=2mol/L,由稀释前后氯离子的物质的量不变可知,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为2mol/L×$\frac{25}{500}$=0.1mol/L,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器为玻璃棒、100mL容量瓶,
故答案为:1mol/L;0.1mol/L;玻璃棒、100mL容量瓶;
(2)3Cl2+6KOH(浓)═5KCl+KClO3+3H2O中,Cl元素失去电子被氧化,Cl元素的得到电子被还原,则氧化产物与还原产物的物质的量之比为1:5;3molCl2参加该反应时,只有1molCl作还原剂,由化合价变化可知转移电子为1mol×(5-0)=5mol,
故答案为:1:5;5;
(3)①还原过程的反应式为NO3-+4H++3e-→NO+2H2O,则具有还原性的物质可使还原反应发生,只有Cu2O符合,Cu元素的化合价升高,则该氧化还原反应为:Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,
故答案为:Cu2O+HNO3→NO↑+Cu(NO3)2+H2O;
②反应中因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸与硝酸中N元素的化合价相同,则体现硝酸具有酸性,
故答案为:氧化性和酸性.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握氧化还原反应中转移的电子数的计算,明确化合价的变化是分析的关键.


科目:高中化学 来源: 题型:解答题
 某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
某化学实验小组为探究氯气漂白原理,设计了以下实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
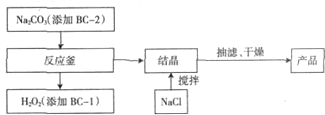
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
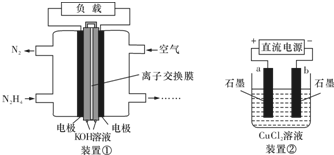
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气能使湿润的蓝色石蕊试纸变为红色 | |
| B. | N2中有少量的杂质CO,可将混合气体通过灼热的氧化铜除去CO | |
| C. | 200mL3mol.L-1BaCl2溶液跟100mL3mol.L-1KCl溶液混合后,溶液中c(Cl-)仍然是3 mol/L | |
| D. | 溶液、浊液、胶体的本质区别是粒子直径的大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cl-、NH4+、AlO2-、SO42- | |
| B. | 常温下,pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| C. | 室温下,水电离出的c(OH-)=10-13mol•L-1的溶液中:K+、HCO3-、Br-、Ba2+ | |
| D. | 使甲基橙变红的溶液中:Fe2+、Al3+、I-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com