
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
右图中的曲线表示在一定条件下,2NO + O2 2NO2 △H<0,反应中NO的转化率与温度的关系。图中标出a、b、c、 d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是
2NO2 △H<0,反应中NO的转化率与温度的关系。图中标出a、b、c、 d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是
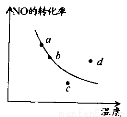
A.a点 B.b点 C.c点 D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把Mg粉放入FeCl3溶液中:2Fe3++3Mg+6H2O=2Fe(OH)3↓+3 Mg2++3H2↑ | |
| B. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO?+SO2+H2O=CaSO3↓+2HClO | |
| C. | 氯化铝溶液中加入偏铝酸钠溶液:Al3++3AlO2-+6H2O=4Al(OH)3↓ | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦⑧⑨ | B. | ②④⑥⑦⑧⑨ | C. | ①④⑥⑧ | D. | ①②④⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
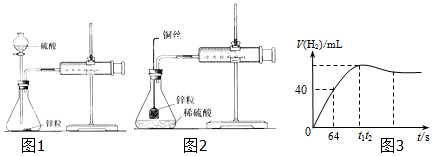
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
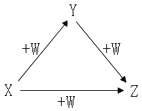 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉可用于酿酒 | |
| B. | 13g苯中含C-H键的数目是NA | |
| C. | 1mol的金刚石中含4NA根C-C键 | |
| D. | 标准状况下,11.2L甲烷和乙烯的混合物含氢原子数是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com