
| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和苯 | D. | 硝基苯和水 |
科目:高中化学 来源: 题型:解答题
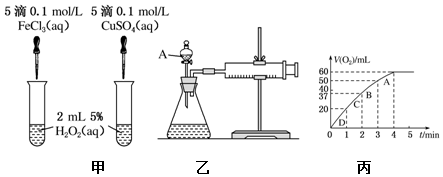
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,NH4+、Fe2+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、Ag+、H+、NO3-可以大量共存 | |
| C. | 向该溶液中通入SO2气体,反应的离子方程式为SO2+3CIO-+H2O═SO42-+CI-+2HCIO | |
| D. | 向该溶液中加入浓盐酸,反应的离子方程式为CIO-+CI-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.08g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g | |
| B. | 生成沉淀的最大质量为10.88g | |
| C. | 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L | |
| D. | 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,并放入几粒沸石[KS5UKS5U] | |
| B. | 可以不用温度计 | |
| C. | 冷水从冷凝管上口入,下口出 | |
| D. | 取少量收集到的液体滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 证明乙二酸具有还原性 | 向乙二酸溶液中滴加2 滴KMnO4溶液 |
| B | 制备Fe(OH)3胶体 | 将NaOH溶液滴加到饱和FeCl3溶液中 |
| C | 铝可以从铜盐溶液中置换铜 | 将久置在空气中的铝片放入CuSO4溶液中 |
| D | 检验蔗糖是否水解 | 取蔗糖溶液,加3~5滴稀硫酸,水浴加热5min,取少量溶液,加入银氨溶液加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com