
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7;Ka2=5.6×10-11 |
| A、物质的量浓度相等的三种溶液中,pH大小关系为:pH( NaCN)>pH(Na2 CO3 )pH(CH3COONa) |
| B、amol?L-1 HCN与6 mol?L-1NaOH溶液等体积混合所得的溶液中c(Na+)>c(CN-),则a一定小于b |
| C、向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小 |
| D、将0.1 mol?L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| SiHCl3(g) Si-H | SiHCl3(g) Si-Cl | H2(g) H-H | HCl(g) H-Cl | |
| 键能(KJ/mol) | 377 | 360 | 436 | 431 |
| A、186KJ/mol |
| B、181KJ/mol |
| C、372KJ/mol |
| D、362KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
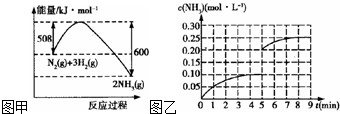
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(A)=0.5 mol/(L?min) |
| B、V(B)=1.2 mol/(L?min) |
| C、V(C)=0.4 mol/(L?min ) |
| D、V(C)=1.1 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2) |
| n(CO) |
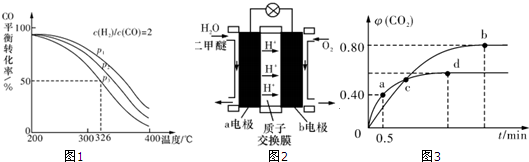
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,还和胶体的知识有关 |
| B、从海水中提取食盐的过程,实际上就是蒸发海水、食盐晶体结晶析出的过程 |
| C、把大豆磨碎后,用水溶解其中的可溶性成分,经过滤后,分成豆浆和豆渣 |
| D、厨房中色拉油与凉开水混在一起,可采用过滤的方法进行分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com