
 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.分析 (1)实验中防止试管与塞子之间漏气,应检验气密性,可利用加热法检验气密性;
(2)酯化反应为可逆反应,且生成水,浓硫酸具有吸水性;
(3)饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)A.加热液体时防止剧烈沸腾;
B.乙酸、乙醇易溶于水,应防止倒吸;
C.乙酸乙酯的密度比水的密度小;
D.酯化反应时乙醇脱H.
解答 解:(1)检验该装置气密性的方法是将导气管的末端插入水槽中,用手握住试管或用酒精灯对其进行微热,这样试管中的气体受热膨胀,在导气管末端会有气泡产生.在松开手或撤离酒精灯以后,导气管末端有一段水柱上升,则证明该装置的气密性良好,不漏气,
故答案为:将导气管的末端插入水槽中,用手握住试管或用酒精灯对其进行微热,这样试管中的气体受热膨胀,在导气管末端会有气泡产生.在松开手或撤离酒精灯以后,导气管末端有一段水柱上升,则证明该装置的气密性良好,不漏气;
(2)酯化反应为可逆反应,且生成水,浓硫酸具有吸水性,则浓硫酸的作用为催化剂、吸水剂,故答案为:催化剂和吸水剂;
(3)饱和碳酸钠可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,则饱和碳酸钠溶液的作用为吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,
故答案为:吸收乙醇;中和乙酸;降低乙酸乙酯的溶解度;
(4)A.加热液体时防止剧烈沸腾,则向a试管中加入沸石,其作用是防止加热时液体暴沸,故A正确;
B.乙酸、乙醇易溶于水,应防止倒吸,则导管不伸入到试管b中的液面的原因是防止倒吸,故B正确;
C.乙酸乙酯是一种无色透明、密度比水小的油状液体,故C错误;
D.酯化反应时乙醇脱H,若原料为CH3COOH和CH3CH218OH,则乙酸乙酯中含18O,故D错误;
故选AB.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能为解答关键,侧重分析与实验能力的考查,注意气密性的检验方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡常数K增大 | B. | a+b<c+d | C. | X的转化率下降 | D. | Z的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
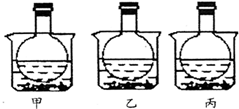 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )| A. | 甲烧瓶中气体颜色变浅 | B. | 乙烧瓶中气体颜色变深 | ||
| C. | 丙烧瓶中气体压强明显增大 | D. | 上述三种说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
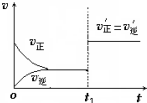 在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).
在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com