
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
分析 A.卤素单质的熔沸点自上而下逐渐升高,而碱金属的熔沸点自上而下逐渐降低;
B.核外电子排布相同的微粒可能为分子、离子等;
C.同主族从上到下非金属性减弱,则最高价含氧酸的酸性逐渐减弱;
D.ⅣA族从上到下非金属性减弱,氢化物的稳定性减弱、沸点增大,但ⅤA、ⅥA、ⅤⅡA中氨气、水、HF的沸点及稳定性在同族最大.
解答 解:A.卤素单质的熔沸点自上而下逐渐升高,而碱金属的熔沸点自上而下逐渐降低,则熔沸点与单质存在的作用力有关,故A错误;
B.核外电子排布相同的微粒可能为分子、离子等,如Ne与钠离子的电子排布相同,性质不同,故B错误;
C.同主族从上到下非金属性减弱,则最高价含氧酸的酸性逐渐减弱,同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱,故C正确;
D.ⅤA、ⅥA、ⅤⅡA中氨气、水、HF的沸点及稳定性在同族最大,硫化氢比H2Se稳定,但沸点H2S<H2Se,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①③⑤⑥ | C. | ①③⑥⑦ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将SO2中通入硝酸钡溶液中 | 有白色沉淀生成 | BaSO3不溶于硝酸 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液先变蓝后褪色 | Cl2先表现氧化性、后表现强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
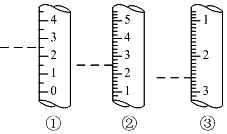 托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入银氨溶液,并水浴加热 | |
| B. | 加入2~3滴石蕊试液 | |
| C. | 先加入浓NaOH溶液,加热蒸馏,把蒸馏出的物质加银氨溶液并水浴加热 | |
| D. | 直接蒸馏,把蒸馏出的物质加NaOH溶液调至碱性,再加银氨溶液,并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
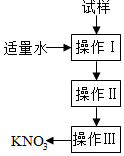 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共只需一次过滤操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com