
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
分析 (1)根据化学平衡常数概念:生成物浓度幂之积与反应物浓度幂之积之比可得,注意固体纯液体不写入;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率=$\frac{物质的转化量}{物质的起始量}×100%$计算;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,配平书写方程式;
580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比;
(4)已知:①WO2(s)+2H2(g)═W(s)+2H2O (g)△H=+66.0kJ•mol-1
②WO2(g)+2H2(g)═W(s)+2H2O (g)△H=-137.9kJ•mol-1
根据盖斯定律,①-②可得.
解答 解:(1)反应WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g),K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$,故答案为:K=$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$;
(2)由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率为$\frac{3mol}{2mol+3mol}×100%$=60%;
故答案为:60%;
(3)由表中主要成分与温度关系可知,第一阶段反应为WO3与H2反应是W2O5,同时还生成H2O,反应方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O,580℃时,温度介于550℃~600℃,固体为W2O5、WO2的混合物;
假定有2molWO3,由2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O、W2O5+H2$\frac{\underline{\;高温\;}}{\;}$2WO2+H2O、WO2+2H2$\frac{\underline{\;高温\;}}{\;}$W+2H2O,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4,
故答案为:2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;1:1:4;
(4)已知:①WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H1=+66.0kJ•mol-1
②WO2 (g)+2H2?W (s)+2H2O (g);△H2=-137.9kJ•mol-1
根据盖斯定律,①-②得WO2(s)?WO2 (g),故该反应的△H=△H1-△H2=+203.9kJ•mol-1;
故答案为:+203.9kJ•mol-1.
点评 本题考查化学平衡常数的书写、化学平衡移动原理、化学平衡计算、盖斯定律等,题目选择的素材比较陌生,注意△H有符号,以考查学生的能力为主,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
| A. | 化合反应 | B. | 可逆反应 | C. | 置换反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
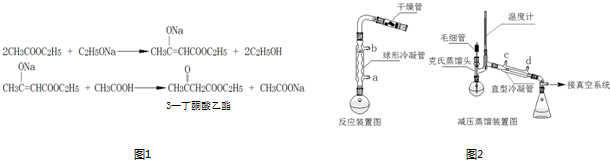
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| E/(KJ•mol-1) | 803 | 742 | 577 | 339 | 465 |
| 达到平衡所需的时间/min | a的数值 | b的数值 | |
| 催化剂A | t | a1 | b1 |
| 催化剂B | 2t | a2 | b2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡常数K增大 | B. | a+b<c+d | C. | X的转化率下降 | D. | Z的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com