
 ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
| A. | 化合反应 | B. | 可逆反应 | C. | 置换反应 | D. | 氧化还原反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K越小,达到平衡时,反应物的转化率越大 | |
| C. | K随反应物浓度的改变而改变 | |
| D. | K随温度和压强的改变而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①③⑤⑥ | C. | ①③⑥⑦ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 加入催化剂有利于氨催化氧化的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将SO2中通入硝酸钡溶液中 | 有白色沉淀生成 | BaSO3不溶于硝酸 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液先变蓝后褪色 | Cl2先表现氧化性、后表现强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
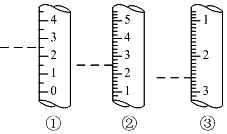 托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com